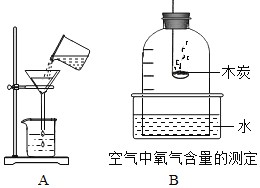
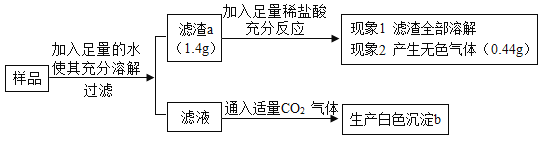
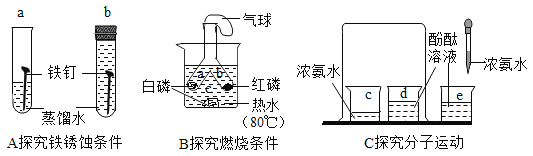
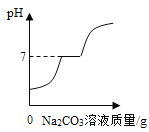
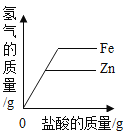
题目内容
【题目】江西大余县,是享誉全球的“世界钨都”,盛产钨。工业上提炼金属钨的工艺流程如下图所示:

(1)在空气中焙烧时,要把黑钨矿研碎,研碎的目的是_________。
(2)黑钨矿(含有FeWO4)与Na2CO3混合在空气中焙烧发生的化学反应方程式为![]() ,X的化学式为____________。
,X的化学式为____________。
(3)在H2WO4中钨元素的化合价为___________。
(4)H2WO4受热分解生成物为WO3和__________。
(5)H2与WO3在高温条件下发生置换反应,该反应的化学方程式为___________。
【答案】增大反应物接触面积,充分反应 Fe2O3 +6 H2O 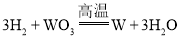
【解析】
(1)把黑钨矿研碎,研碎的目的是增大反应物接触面积,充分反应;
(2)黑钨矿(含有FeWO4 )与Na2CO3混合在空气中焙烧发生的化学反应方程式为![]() ,根据质量守恒定律可知,反应前后Fe、W、O、Na、C原子的个数分别为4、4、30、8、4,0、4、24、8、4。反应前后相差4个Fe原子、6个O原子,又X前的化学计量数为2,故X的化学式为Fe2O3;
,根据质量守恒定律可知,反应前后Fe、W、O、Na、C原子的个数分别为4、4、30、8、4,0、4、24、8、4。反应前后相差4个Fe原子、6个O原子,又X前的化学计量数为2,故X的化学式为Fe2O3;
(3)在H2WO4中H为+1,O为-2,根据化合物中元素正负价化合价代数和为0,可知钨元素的化合价为0-(+1×2)-(-2×4)=+6;
(4)根据质量守恒定律(即反应前后原子的种类和个数不变)可知,H2WO4受热分解生成H2O和WO3;
(5)H2具有还原性,能将金属氧化物还原为纯金属。根据H2与WO3在高温条件下发生置换反应可知,生成物为H2O和W,反应的化学方程式为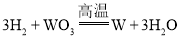 。
。

【题目】今天是某校实验室开放日,晓明同学用锌和稀硫酸反应制取氢气。先向气体发生装置中加入一定量的锌粒,然后将60克稀硫酸分三次加入,每次生成气体的质量如下表:
次数 | 第一次 | 第二次 | 第三次 |
加入稀硫酸质量/g | 20 | 20 | 20 |
生成氢气的质量/g | 0.08 | 0.08 | 0.04 |
试计算:
(1)共制得氢气_____g和共加入_____g锌粒。
(2)实验所用稀硫酸中溶质的质量分数。_____(写出计算过程)