题目内容
【题目】下图是水厂利用水库中的水生产自来水的主要流程:
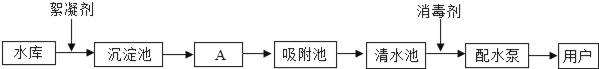
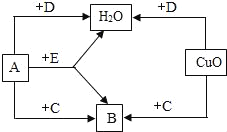
请回答下列问题:(1)水库中的水属于_____(填“纯净物”或“混合物”).
(2)①A池中通过_____(填操作名称)除去水中的固体杂质.②国家规定的自来水PH范围为6.5﹣8.5.为了测定家用自来水是否达到这一标准,可用_____来进行检测.
(3)自来水中通常都含有Cl﹣,可以在水样中滴加少量稀硝酸和_____检验,若出现_____现象,说明水中含有Cl﹣.水中的Ca2+、Mg2+受热后转化为沉淀,即通常所说的水垢,水垢的主要成分为_____.
(4)把自来水进一步净化为蒸馏水的实验方法是_____,实验室制取蒸馏水的蒸馏烧瓶里,通常要加入几粒沸石或碎瓷片,作用是_____.
【答案】混合物 过滤 pH计 硝酸银 白色沉淀 碳酸钙和氢氧化镁 蒸馏 防止暴沸
【解析】
解:(1)由于水库中的水处于敞开的环境中,混入了一些物质,所以,水库中的水属于混合物;
(2)①过滤是将不容物和液体进行分离的操作,A池中通过过滤除去水中的固体杂质;
②pH试纸只能读出整数值,为了测定家用自来水的酸碱度,应用pH计来进行精确检测;
(3)自来水中通常都含有Cl﹣,可以在水样中滴加少量稀硝酸和硝酸银检验,若出现白色沉淀现象,说明水中含有Cl﹣,水中的Ca2+,Mg2+受热后转化为沉淀,即通常所说的水垢,水垢的主要成分为碳酸钙和氢氧化镁;
(4)把自来水进一步净化为蒸馏水的实验方法是蒸馏.实验室制取蒸馏水的蒸馏烧瓶里,通常要加入几粒沸石或碎瓷片,作用是防止暴沸.

【题目】实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)定性探究:
Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含____;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有____ |
取上层清液,滴加____ | ____ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:
![]()
同学们认为:原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是___(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)定量探究:
在老师的指导下同学们又精确称量了10g原固体,进行如下实验:
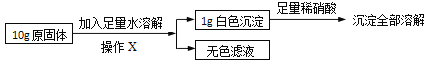
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是____,则原固体中一定不含____;其中,操作X的名称是____,无色滤液中一定含有的阳离子是____。
试根据生成沉淀的质量计算原固体中氯化钙的质量分数,写出计算过程_____。
【题目】KCl的溶解度曲线如图所示。在下表对应的温度下,向4只盛有100 g水的烧杯中,分别加入40 g KCl固体,充分溶解。
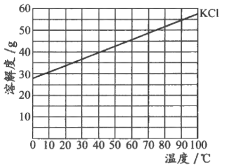
烧杯序号 | ① | ② | ③ | ④ |
温度(℃) | 20 | 30 | 50 | 60 |
下列关于①~④所得溶液的说法不正确的是
A. 溶质质量:①<②
B. 溶液质量:②<③
C. 溶质质量分数:③<④
D. ④中溶质与溶剂的质量比为2: 5