题目内容
【题目】某化学兴趣小组在做完用石灰石和稀盐酸制取二氧化碳的实验后,对反应后的剩余溶液的溶质成分产生了兴趣,他们进行了以下实验探究。
【提出猜想】猜想一:只有CaCl2;猜想二:______________。
【实验探究】为了验证猜想,该兴趣小组的同学设计了如下实验方案。
方案编号 | 方案1 | 方案2 |
实验操作 (分别取少量实验后的溶液于试管中) | 加入几滴紫色的石蕊试液 | 滴加硝酸银溶液 |
实验现象 | 产生白色沉淀。 | |
实验结论 | 猜想二成立。 | |
【评价反思】(1)方案1观察到的实验现象______________。
(2)有同学提出方案2是错误的,原因是__________________。
(3)该兴趣小组的小华同学观察到石灰石和稀盐酸反应后容器内有少量固体剩余,得出溶液中肯定没有盐酸的结论,其他同学认为小华的说法不合理,其理由是__________________。
(4)请你设计一个与上述不同的实验方案(说出实验步骤和现象)________________ 。
【拓展延伸】石灰石的主要成分碳酸钙可用作补钙剂。某补钙药剂说明书的部分信息如图所示。现将100g盐酸分成5等份,逐次加到用25片该药剂制成的粉末中(其他成分不与盐酸反应,也不溶于水),得到图像如下。请根据有关信息回答问题。
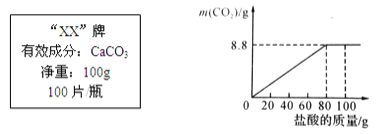
(1)该品牌补钙药剂中CaCO3的质量分数是____________。
(2)当加入盐酸和25片该药剂完全反应时,求所得溶液中溶质的质量分数?(写出计算过程,计算结果保留0.1%)_______________。
【答案】 CaCl2和HCl 石蕊溶液变红色 氯化钙也能与硝酸银反应生成白色沉淀 剩余固体可能完全是杂质 合理答案即可 80% 24.3%
【解析】石灰石和稀盐酸制取二氧化碳的反应为:CaCO3 +2HCl ==CaCl2+ CO2↑ + H2O,所以反应后溶液中一定有氯化钙,可能有过量的盐酸,溶质有两种可能①CaCl2或②CaCl2和HCl;【评价反思】(1)方案1观察到的实验现象当溶质为CaCl2和HCl时溶液呈酸性,能使紫色石蕊变红;(2)有同学提出方案2是错误的,原因是氯化钠和盐酸都能与硝酸银反应生成氯化银白色沉淀,所以加入硝酸银生成白色沉淀,不能证明酸过量,即方案2错误;(3) 石灰石中的杂质不与盐酸反应,所以充分后会有固体剩余物。(4)想反应后的溶液中加入碳酸钠,固体逐渐减少,有气泡产生,可证明反应后溶液中的溶质为:【拓展延伸】由题中信息可知,刚好完全反应消耗盐酸的质量为80,设该品牌补钙药剂中CaCO3的质量分数是x ,生成氯化钙的质量为y,则
CaCO3 +2HCl ==CaCl2 + CO2↑ + H2O
100 111 44
X y 8.8g
100/x=44/8.8g x=20g
111/y=44/8.8g y=22.2g
所得溶液中溶质的质量分数=22.2g÷(20g+80g-8.8g)×100%≈24.3%
该品牌补钙药剂中CaCO3的质量分数20g÷25g×100%=80%;
答:略

【题目】亮亮做家务时接触到下列用品。
用品 | 脱氧剂 | 洁厕灵 | 炉灶清洁剂 |
有效成分 | 还原铁粉 | 盐酸 | 氢氧化钠 |
(1)他清理垃圾时发现一袋脱氧剂,拆开后看到还原铁粉已生锈,铁生锈的原因是_________。
(2)他选用洁厕灵清除水垢(主要成分是碳酸钙),用化学方程式表示其原理________。
(3)他清洗炉灶时戴上橡胶手套,以防清洁剂与皮肤直接接触,其原因是__________。
(4)做完家务,他用Vc泡腾片冲了一杯饮料。下列Vc泡腾片的主要成分中,属于有机物的是__________(填字母序号)。
A.维生素C(![]() ) B.柠檬酸(
) B.柠檬酸(![]() ) C.碳酸氢钠(
) C.碳酸氢钠(![]() )
)