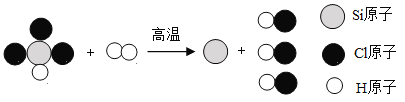
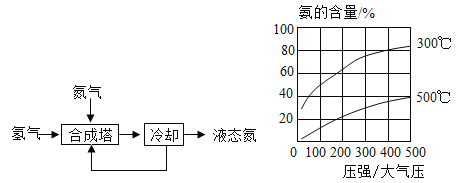
题目内容
【题目】我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了杰出贡献。在实际生产的产品碳酸钠中会混有少量的氯化钠,现有纯碱样品,为测定该样品中碳酸钠的质量分数,称取样品6 g,放入20 g水中使其完全溶解,再加入稀盐酸26. 2 g,恰好完全反应,气体全部逸出,得到不饱和氯化钠溶液,溶液的总质量为50 g。试计算:
(1)生成二氧化碳的质量为多少g。
(2)样品中碳酸钠的质量。
(3)反应后所得溶液中溶质的质量分数。
【答案】(1)2.2(2)5.3g(3)13.1%
【解析】
(1)根据质量守恒定律可知,反应前后的物质的总质量不变,则反应前的质量为:6g+20g+26.2g=52.2g,反应后溶液的质量为50g,则相差的质量就是生成气体的质量,即:52.2g-50g=2.2g。故答案为:2.2;
(2)设参加反应的碳酸钠的质量为x,生成的氯化钠的质量为y。

解得x=5.3g,y=5.85g。
则样品中,碳酸钠的质量为5.3g。
(3)根据题意可知,两种溶液混合后,恰好完全反应,则此时得到的是氯化钠溶液。通过分析题意可知,氯化钠有两种来源,一种是样品中含有的,质量为6g-5.3g=0.7g。一种是碳酸钠和盐酸反应生成的氯化钠,质量为5.85g。则反应后溶质的质量为:5.85g+0.7g=6.55g。溶液的质量为50g,则恰好完全反应时,溶质的质量分数为:![]() 。
。

练习册系列答案
相关题目