题目内容
【题目】向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应,过滤。下面对反应结果的判断,不正确的是
A.若反应后溶液为蓝色,滤渣中一定不含有Zn
B.若反应后溶液为蓝色,滤渣中一定含有Ag,可能含有Cu
C.若反应后溶液为无色,滤渣中一定含有Ag和Cu
D.若反应后溶液为无色,滤渣中一定不含有Zn
【答案】D
【解析】
向![]() 的混合溶液中加入一定量的锌粉,锌先与硝酸银反应生成生成硝酸锌和银,硝酸银反应完全后,锌再与硝酸铜反应生成硝酸锌和铜;
的混合溶液中加入一定量的锌粉,锌先与硝酸银反应生成生成硝酸锌和银,硝酸银反应完全后,锌再与硝酸铜反应生成硝酸锌和铜;
A、若反应后溶液为蓝色,说明硝酸铜有剩余,锌与硝酸铜反应不能共存,滤渣中一定不含有Zn,说法正确;
B、若反应后溶液为蓝色,滤渣中一定含有Ag,若硝酸铜部分参加反应,则滤渣含有铜,若硝酸铜未参加反应,则滤渣没有铜,说法正确;
C、若反应后溶液为无色,说明硝酸铜已全部反应,滤渣中一定含有Ag和Cu,说法正确;
D、若反应后溶液为无色,说明硝酸铜已全部反应,锌可能有剩余,滤渣中可能含有Zn,说法错误。
故选:D。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案【题目】碳酸钠在生产和生活中具有重要的用途。某化学兴趣小组为探究碳酸钠的化学性质,进行了如下实验。向盛有适量碳酸钠溶液的四支试管中分别加入下列试剂,实验现象记录如下:
试管编号 | 1 | 2 | 3 | 4 |
加入试剂 | 无色酚酞试液 | 稀盐酸 | 澄清石灰水 | 氯化钡溶液 |
实验现象 | 有气泡产生 | 有白色沉淀产生 | 有白色沉淀产生 |
试管1中的实验现象是__________。
试管2中发生反应的化学方程式___________。
化学兴趣小组的同学们对反应后试管中的溶质进一步探究:某一小组将试管3、4中的物质分别过滤,得到滤液A和B。
甲、乙两同学对滤液A中溶质的成分进行探究:
(提出问题)滤液A中溶质的成分是什么?
(猜想假设)猜想一:NaOH
猜想二:NaOH和Na2CO3
猜想三:__________。
(进行实验)
实验操作 | 实验现象 | 实验结论 |
甲:取少量滤液A于试管中,加入过量稀盐酸 | 有气泡生成 | 猜想 成立 |
乙:_______ | 有白色沉淀生成 |
(实验结论)通过实验,甲、乙两同学均验证猜想________成立,乙同学的实验操作为_______。
(实验拓展)丙同学取一定量的滤液A和B于小烧杯中混合,有白色沉淀生成。该反应的实质是_______(从离子相互结合的角度分析)。
(反思与评价)
(1)碳酸钠溶液呈碱性,可以和盐酸,氢氧化钙和氯化钡等物质发生反应。
(2)要验证反应后物质的成分,既要验证生成物,还应考虑反应物。
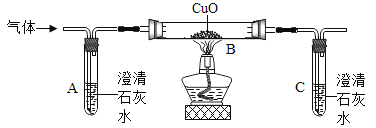
【题目】甲、乙、丙三个实验小组分别利用2g铜粉 “测定空气中氧气的含量”,实验装置见右图。课外兴趣小组为研究实验中铜粉的氧化情况,又进行以下实验:
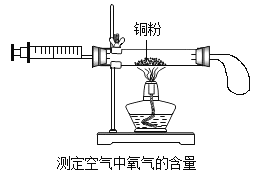
①兴趣小组将甲、乙、丙三个实验小组硬质玻璃管中的残留固体全部取出,称量后,置于烧杯中;
②在烧杯中加入足量稀硫酸使之充分反应,将剩余固体过滤、洗涤、干燥、称量;相关数据见下表:
甲组 | 乙组 | 丙组 | |
反应前固体质量 | 2.016g | 2.016g | 2.024g |
反应后固体质量 | 1.936g | 1.936g | 1.904g |
(1)烧杯中发生反应的化学方程式为__________。
(2)甲、乙两组实验数据相同,残留固体中氧化铜的质量为____________,丙组残留固体中氧化铜的质量为___________。
(3)兴趣小组通过分析数据得出:甲、乙两组实验数据更接近实际空气中氧气的含量,丙组差异较大。你认为丙组在“测定空气中氧气的含量”实验中,可能存在的操作失误是_________。