题目内容
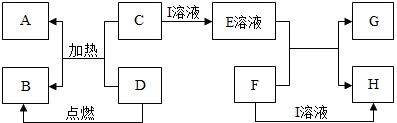
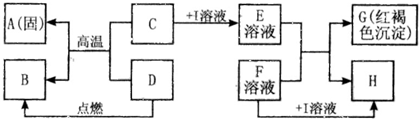
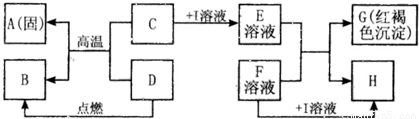
在如图所示的有关物质转化关系中,各物质均是我们初中化学所学的物质.A是一种金属单质,C为一种固体粉末,D为一种气体,E、H都属于盐.框图中有关反应的部分生成物没有标出.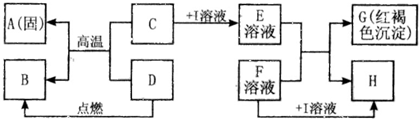
请根据框图中物质的转化关系填写下列空白:
(1)A的一种用途是
(2)C→E的基本反应类型是
(3)若H为难溶性的盐,则I的化学式为
(4)D→B的化学方程式是

请根据框图中物质的转化关系填写下列空白:
(1)A的一种用途是
制作炊具
制作炊具
;(2)C→E的基本反应类型是
复分解反应
复分解反应
;(3)若H为难溶性的盐,则I的化学式为
H2SO4
H2SO4
;(4)D→B的化学方程式是
2CO+O2
2CO2
| ||
2CO+O2
2CO2
.
| ||
分析:(1)根据红褐色沉淀属于氢氧化铁,说明E溶液中含有铁离子,所以C为一种含三价铁的化合物,可以是氧化铁,再推出A的物质名称,进而回答用途;(2)由于C为铁的氧化物是不溶于水的,需要加入酸才能反应,再根据金属氧化物与酸反应的类型考虑;(3)由于I属于酸,如果是盐酸要产生氯化物沉淀必须是氯化银沉淀,又因为F属于碱所以不能与银离子结合,再进行判断酸属于什么酸;(4)D与铁的氧化物反应生成铁,说明D具有还原性,再根据三大还原剂进行考虑.
解答:解:(1)E溶液与F溶液生成的红褐色沉淀属于氢氧化铁,又因为C与D反应能生成金属A,所以A是金属铁,铁具有导热性,可以用来制作铁锅等炊具;
(2)由于氢氧化铁中铁元素是+3价,所以C为一种含三价铁的化合物,可以是氧化铁,是不溶于水的,需要加入酸才能反应,金属氧化物与酸反应生成盐和水,是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应;
(3)E溶液中含有铁离子溶液,因为E和F生成氢氧化铁沉淀,所以F溶液属于碱,由于I属于酸,如果是盐酸要产生氯化物沉淀必须是氯化银沉淀,又因为F属于碱所以不能与银离子结合,I可以是硫酸,F为氢氧化钡溶液就行,及E溶液是硫酸铁,F溶液是氢氧化钡,反应后生成氢氧化铁沉淀和硫酸钡沉淀,符合题意了;
(4)D与氧化铁反应生成铁,说明D具有还原性,三大还原剂是氢气、一氧化碳和碳,因为D为一种气体,可以是氢气或一氧化碳,如果是氢气,B就是水,如果是一氧化碳,B就是二氧化碳,假设是一氧化碳,反应物是一氧化碳和氧气,生成物是二氧化碳,用观察法配平,反应条件是点燃写在等号的上边.
故答案为:(1)制作炊具;(2)复分解反应;(3)H2SO4;(4)2CO+O2
2CO2.
(2)由于氢氧化铁中铁元素是+3价,所以C为一种含三价铁的化合物,可以是氧化铁,是不溶于水的,需要加入酸才能反应,金属氧化物与酸反应生成盐和水,是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应;
(3)E溶液中含有铁离子溶液,因为E和F生成氢氧化铁沉淀,所以F溶液属于碱,由于I属于酸,如果是盐酸要产生氯化物沉淀必须是氯化银沉淀,又因为F属于碱所以不能与银离子结合,I可以是硫酸,F为氢氧化钡溶液就行,及E溶液是硫酸铁,F溶液是氢氧化钡,反应后生成氢氧化铁沉淀和硫酸钡沉淀,符合题意了;
(4)D与氧化铁反应生成铁,说明D具有还原性,三大还原剂是氢气、一氧化碳和碳,因为D为一种气体,可以是氢气或一氧化碳,如果是氢气,B就是水,如果是一氧化碳,B就是二氧化碳,假设是一氧化碳,反应物是一氧化碳和氧气,生成物是二氧化碳,用观察法配平,反应条件是点燃写在等号的上边.
故答案为:(1)制作炊具;(2)复分解反应;(3)H2SO4;(4)2CO+O2
| ||
点评:解答本题的突破口是红褐色沉淀,要知道红褐色沉淀是氢氧化铁,推出金属A是铁,还需要知道铁的氧化物不溶于水,需要与酸反应才能溶解,再结合学过去的知识进行进一步的分析.

练习册系列答案
相关题目
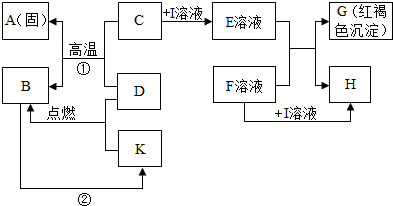 在如图所示的有关物质转化关系中,各物质均是我们初中化学所学的物质.A是金属单质,C为红棕色固体粉末,B、D、K常温下都为气体,E、H都属于盐,F为能溶于水的碱.框图中有关反应的部分生成物没有标出.请根据框图中物质的转化关系填写下列空白:
在如图所示的有关物质转化关系中,各物质均是我们初中化学所学的物质.A是金属单质,C为红棕色固体粉末,B、D、K常温下都为气体,E、H都属于盐,F为能溶于水的碱.框图中有关反应的部分生成物没有标出.请根据框图中物质的转化关系填写下列空白: