题目内容
碱石灰是实验室中常用的干燥剂.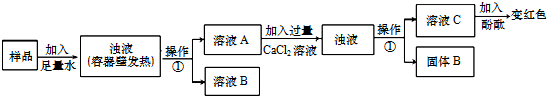
【资料】
①碱石灰是氧化钙、氢氧化钠的固体混合物,易吸收空气中二氧化碳和水蒸气.
②氯化钙溶液呈中性.
【提出问题】对实验室中久置的碱石灰样品的成分进行探究.
【进行猜想】
久置碱石灰样品中可能含有CaO、NaOH、Ca(OH)2、Na2CO3、CaCO3中的两种或两种以上成分.
样品中可能含有Ca(OH)2、Na2CO3的原因是(请用化学方程式表示) 、 .
【实验过程】
试回答下列问题:
(1)根据实验操作及现象,下列说法正确的是 .
A、样品中加水后容器壁发热,说明样品中一定含有CaO
B、样品加足量水后仍有固体,说明样品中一定含有CaCO3
C、溶液A加入CaCl2溶液后产生固体,说明样品中一定含有Na2CO3
D、溶液C加入酚酞变红,说明样品中一定含有NaOH
(2)向溶液A中加入过量的CaCl2溶液的操作中,判断加入试剂过量的方法是 .
(3)写出溶液C中所含阴离子的符号 .
【实验结论】
该久置碱石灰样品中肯定含有的成分是(填化学式) ,其它成分尚不能确定.

【资料】
①碱石灰是氧化钙、氢氧化钠的固体混合物,易吸收空气中二氧化碳和水蒸气.
②氯化钙溶液呈中性.
【提出问题】对实验室中久置的碱石灰样品的成分进行探究.
【进行猜想】
久置碱石灰样品中可能含有CaO、NaOH、Ca(OH)2、Na2CO3、CaCO3中的两种或两种以上成分.
样品中可能含有Ca(OH)2、Na2CO3的原因是(请用化学方程式表示)
【实验过程】
试回答下列问题:
(1)根据实验操作及现象,下列说法正确的是
A、样品中加水后容器壁发热,说明样品中一定含有CaO
B、样品加足量水后仍有固体,说明样品中一定含有CaCO3
C、溶液A加入CaCl2溶液后产生固体,说明样品中一定含有Na2CO3
D、溶液C加入酚酞变红,说明样品中一定含有NaOH
(2)向溶液A中加入过量的CaCl2溶液的操作中,判断加入试剂过量的方法是
(3)写出溶液C中所含阴离子的符号
【实验结论】
该久置碱石灰样品中肯定含有的成分是(填化学式)
考点:实验探究物质的组成成分以及含量,生石灰的性质与用途,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:【进行猜想】根据题目信息可知,碱石灰的成分是氧化钙和氢氧化钠,氧化钙和水生成氢氧化钙;氢氧化钠和二氧化碳生成碳酸钠.则可写出化学方程式;
[实验过程]
(1)根据实验现象结合物质的性质及溶解时的吸热放热现象来解答;
(2)若氯化钙过量则继续加入碳酸钠溶液会产生沉淀,所以可以据此推断;
(3)溶液C能够使酚酞变红,说明含有氢氧根离子;
[实验结论]由实验现象得出实验结论.
[实验过程]
(1)根据实验现象结合物质的性质及溶解时的吸热放热现象来解答;
(2)若氯化钙过量则继续加入碳酸钠溶液会产生沉淀,所以可以据此推断;
(3)溶液C能够使酚酞变红,说明含有氢氧根离子;
[实验结论]由实验现象得出实验结论.
解答:解:
【进行猜想】根据题目信息可知,碱石灰的成分是氧化钙和氢氧化钠,氧化钙和水生成氢氧化钙,氢氧化钠和二氧化碳生成碳酸钠.故答案为:CaO+H2O═Ca(OH)2;氢氧化钠放置在空气中易与空气中的二氧化碳发生化学反应,生成碳酸钠,而使氢氧化钠变质.故答案应为:CO2+2NaOH═Na2CO3+H2O.
【实验过程】
(1)将样品加入水中后得到较热的浊液,能够使浊液温度升高的是氢氧化钠溶于水放热,氧化钙和水反应放热,故两者都有可能,故排除A;如果固体中含有碳酸钠,其与氢氧化钙接触会产生沉淀,所以在原混合物中不一定有碳酸钙,故排除B;根据所给的物质中能够和氯化钙产生沉淀只有碳酸钠,故可以判断C是正确的;而对于D选项,向溶液C加入酚酞后,酚酞变红虽然可以证明存在着氢氧根离子,但是由于在向样品中加入足量水后,如果样品中同时存在着碳酸钠和氢氧化钙,那么它们要反应生成氢氧化钠,而在后续的操作中不能排除这个反应的干扰,所以不能确定溶液C中的氢氧化钠是来自于样品中,还是反应生成的,故D错;故可以知道该题的答案为:C;
(3)若氯化钙过量则继续滴加碳酸钠溶液会产生白色沉淀,所以可以取上层清液,然后向其中加入碳酸钠溶液看能否继续产生沉淀,即可判断;
(4)酚酞试液只有遇到碱性溶液才会变红,故在溶液中一定存在着氢氧根离子;
【实验结论】根据实验现象即:加入氯化钙溶液产生了白色沉淀,可以得出在该固体中一定含有碳酸钠.
答案:
[进行猜想]CaO+H2O═Ca(OH)2、2NaOH+CO2═Na2CO3+H2O
[实验过程]
(1)C
(2)取少量上层清液滴加碳酸钠溶液,如有白色沉淀产生,则说明加入的试剂过量.
(3)OH-、Cl-;
[实验结论]Na2CO3
【进行猜想】根据题目信息可知,碱石灰的成分是氧化钙和氢氧化钠,氧化钙和水生成氢氧化钙,氢氧化钠和二氧化碳生成碳酸钠.故答案为:CaO+H2O═Ca(OH)2;氢氧化钠放置在空气中易与空气中的二氧化碳发生化学反应,生成碳酸钠,而使氢氧化钠变质.故答案应为:CO2+2NaOH═Na2CO3+H2O.
【实验过程】
(1)将样品加入水中后得到较热的浊液,能够使浊液温度升高的是氢氧化钠溶于水放热,氧化钙和水反应放热,故两者都有可能,故排除A;如果固体中含有碳酸钠,其与氢氧化钙接触会产生沉淀,所以在原混合物中不一定有碳酸钙,故排除B;根据所给的物质中能够和氯化钙产生沉淀只有碳酸钠,故可以判断C是正确的;而对于D选项,向溶液C加入酚酞后,酚酞变红虽然可以证明存在着氢氧根离子,但是由于在向样品中加入足量水后,如果样品中同时存在着碳酸钠和氢氧化钙,那么它们要反应生成氢氧化钠,而在后续的操作中不能排除这个反应的干扰,所以不能确定溶液C中的氢氧化钠是来自于样品中,还是反应生成的,故D错;故可以知道该题的答案为:C;
(3)若氯化钙过量则继续滴加碳酸钠溶液会产生白色沉淀,所以可以取上层清液,然后向其中加入碳酸钠溶液看能否继续产生沉淀,即可判断;
(4)酚酞试液只有遇到碱性溶液才会变红,故在溶液中一定存在着氢氧根离子;
【实验结论】根据实验现象即:加入氯化钙溶液产生了白色沉淀,可以得出在该固体中一定含有碳酸钠.
答案:
[进行猜想]CaO+H2O═Ca(OH)2、2NaOH+CO2═Na2CO3+H2O
[实验过程]
(1)C
(2)取少量上层清液滴加碳酸钠溶液,如有白色沉淀产生,则说明加入的试剂过量.
(3)OH-、Cl-;
[实验结论]Na2CO3
点评:熟练掌握碳酸钠、碳酸钙等碳酸盐和氢氧化钠、氧化钙的化学性质,能根据所给的实验或者自己设计实验来验证它们是否变质,并熟练的写出相应的化学方程式:CaO+H2O═Ca(OH)2、2NaOH+CO2═Na2CO3+H2O.

练习册系列答案
相关题目
下列各项研究中,属于化学学科研究内容的是( )
| A、培育新的花卉品种,增加观赏价值 |
| B、利用指南针确定航海方向 |
| C、综合利用石油生产优质人造纤维 |
| D、设计新程序,开发信息技术 |
经分析得知,某物质中仅含一种元素,则该物质( )
| A、一定是一种物质 |
| B、一定是纯净物 |
| C、一定是混合物 |
| D、可能是纯净物也可能是混合物 |
 实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究:
实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究: 空气质量日报是通过新闻媒体向社会发布的环境信息.空气质量日报主要内容包括“空气污染指致“首要污染物”“空气质量级别”等.根据我国环保部2011年发布的《环境空气质量标准》,基本监控项目中增设了PM2.5浓度限值.请回答问题:
空气质量日报是通过新闻媒体向社会发布的环境信息.空气质量日报主要内容包括“空气污染指致“首要污染物”“空气质量级别”等.根据我国环保部2011年发布的《环境空气质量标准》,基本监控项目中增设了PM2.5浓度限值.请回答问题: