题目内容
【题目】某燃料气体成分可能含有![]() 和
和![]() 等,某化学兴趣小组的同学对该燃料气体样品的成分进行了如下探究:
等,某化学兴趣小组的同学对该燃料气体样品的成分进行了如下探究:
(猜想)①该混合气体只含 有![]() ②该混合气体含有
②该混合气体含有![]() 和
和![]()
③该混合气体只含有![]() 和
和![]() ④该混合气体只含有
④该混合气体只含有![]() 和
和![]()
……
(实验)同学们在老师的指导下设计了如下图所示装置,并进行了实验。提示:每个装置中的药品都足量。白色无水硫酸铜固体遇到水会变蓝色
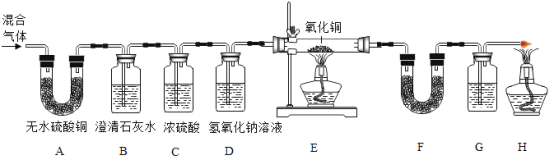
(1)装置A中无水硫酸铜变蓝,B中澄清石灰水变浑浊,B中发生的化学反应方程式为___________。结论:猜想中不符合的为_______________(填猜想中的序号)。
(2)装置C和D的设计有错误地方,如何改进_______________
(3)实验结束后,同学们一致认为猜想③正确。
其中同学们在装置F中加入了无水硫酸铜,你认为在装置G中所加药品最好为_______________,他们所依据的实验现象分别为:E中_______________,F中_______________,G中___________
(4)实验后,有同学对装置A中所得蓝色固体感兴趣,并对其进行实验探究。
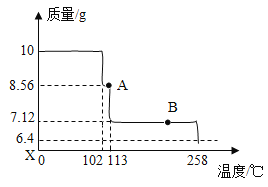
10g ![]() 样品受热脱水过程的热重曲线(固体质量随温度变化的曲线)如下图所示。
样品受热脱水过程的热重曲线(固体质量随温度变化的曲线)如下图所示。
请回答下列问题:
①试确定![]() 时固体物质的化学式__________。(写出解题过程)
时固体物质的化学式__________。(写出解题过程)
②取![]() 所得的样品,于
所得的样品,于![]() 下灼烧得到的主要产物是黑色粉末和一种氧化物气体,该反应的化学方程式为____________。
下灼烧得到的主要产物是黑色粉末和一种氧化物气体,该反应的化学方程式为____________。
③把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体(![]() )析出,其晶体存在的最高温度是__________________。
)析出,其晶体存在的最高温度是__________________。
【答案】![]() ① ④ 装置C和D颠倒 装澄清石灰水 E中黑色固体变为红色 F中无水硫酸铜变蓝 G中无明显现象 CuSO4·H2O CuSO4
① ④ 装置C和D颠倒 装澄清石灰水 E中黑色固体变为红色 F中无水硫酸铜变蓝 G中无明显现象 CuSO4·H2O CuSO4![]() CuO+SO3↑ 102℃
CuO+SO3↑ 102℃
【解析】
(1)二氧化碳与氢氧化钙反应原理:CO2+Ca(OH)2=CaCO3↓+H2O;A装置无水硫酸铜变蓝,则混合气体中有水,B装置中澄清的石灰水变浑浊,则混合气体中有二氧化碳气体,故选①④;
(2)先用装置D中氢氧化钠除去二氧化碳气体,然后用装置C中的浓硫酸吸收水蒸气;
(3)G装置中加入澄清的石灰水,检验是否有二氧化碳气体产生;E装置中黑色固体变为红色,证明有还原性气体,F装置中无水硫酸铜变为蓝色,则一定有水生成,则混合气体中一定有氢气,G装置中澄清的石灰水物明显现象,则没有二氧化碳气体生成,混合气体中一定没有一氧化碳;
(4)①10g的CuSO4·5H2O样品加热全部脱水剩余的质量为:10g×![]() ×100%=6.4g,样品在200℃时,剩余固体质量为7.12g,受热脱水的质量为:10g-7.12g=2.88g,10g样品中结晶水的质量为:10g-6.4g=3.6g,受热脱水的质量与结晶水总质量的比=
×100%=6.4g,样品在200℃时,剩余固体质量为7.12g,受热脱水的质量为:10g-7.12g=2.88g,10g样品中结晶水的质量为:10g-6.4g=3.6g,受热脱水的质量与结晶水总质量的比=![]() =
=![]() ,则受热时,脱去4份结晶水,故化学式:CuSO4·H2O;②当温度大于258℃时,样品全部脱水,只剩余硫酸铜,
,则受热时,脱去4份结晶水,故化学式:CuSO4·H2O;②当温度大于258℃时,样品全部脱水,只剩余硫酸铜,
在570℃时,硫酸铜受热分解:CuSO4![]() CuO+SO3↑③黑色粉末是氧化铜,氧化铜与稀硫酸反应生成硫酸铜溶液,CuO+H2SO4=CuSO4+H2O,硫酸铜溶液经浓缩、冷却,有CuSO4·5H2O析出,该晶体在温度超过102℃时,开始逐渐脱水。
CuO+SO3↑③黑色粉末是氧化铜,氧化铜与稀硫酸反应生成硫酸铜溶液,CuO+H2SO4=CuSO4+H2O,硫酸铜溶液经浓缩、冷却,有CuSO4·5H2O析出,该晶体在温度超过102℃时,开始逐渐脱水。