题目内容
【题目】以下是一些制取气体的实验,请你一起参与探究。
Ⅰ.某探究小组在实验室用下图所示装置制取气体

(1)写出实验室用A装置制取氧气的化学方程式_______________________。
(2)实验室还可用二氧化锰与双氧水制取氧气,如需随时控制反应速率并节约药品,选择的气体发生装置是_________(填编号);。若要收集到浓度和纯度较高的氧气,选择的气体收集装置是_________(填编号)。
(3)若选用F装置进行排空气法收集二氧化碳,气体应从______(填“a”或“b”)端通入,检验二氧化碳已集满的方法是____________________。
Ⅱ.为探究催化剂的种类对过氧化氢分解速度的影响,在相同条件下,同学们按下表进行实验并记录相关数据。(其他影响实验的因素均相同)
编号 | 过氧化氢溶液质量/g | 催化剂质量/g | 待测数据 |
实验1 | 50.0 | MnO2 0.2 | |
实验2 | 50.0 | CuO x |
(1)表中x 的数值应是__________。
(2)表中的待测数据指________________(填字母序号)。
A.氧气的质量 B.单位时间内产生氧气的质量
C.氧气的体积 D.单位时间内产生氧气的体积
(3)实验1充分反应后,固液混合物的质量为48.4g,计算过氧化氢溶液中过氧化氢的质量分数。(写出计算过程)__________。
【答案】 2KClO3![]() 2KCl+3O2↑ C E b 将燃着的木条放在a处,熄灭则满 2.0 B、D 7.65%
2KCl+3O2↑ C E b 将燃着的木条放在a处,熄灭则满 2.0 B、D 7.65%
【解析】根据所学知识和题中信息知,Ⅰ.(1)实验室用A装置制取氧气的化学方程式是2KClO3 ![]() 2KCl+3O2↑ 。(2)实验室还可用二氧化锰与双氧水制取氧气,如需随时控制反应速率并节约药品,选择的气体发生装置是C。若要收集到浓度和纯度较高的氧气,选择的气体收集装置是E。(3)若选用F装置进行排空气法收集二氧化碳,气体应从b端通入,检验二氧化碳已集满的方法是将燃着的木条放在a处,熄灭则满。Ⅱ.(1)表中x 的数值应是2.0g. (2)表中的待测数据指 B.单位时间内产生氧气的质量. D.单位时间内产生氧气的体积.
2KCl+3O2↑ 。(2)实验室还可用二氧化锰与双氧水制取氧气,如需随时控制反应速率并节约药品,选择的气体发生装置是C。若要收集到浓度和纯度较高的氧气,选择的气体收集装置是E。(3)若选用F装置进行排空气法收集二氧化碳,气体应从b端通入,检验二氧化碳已集满的方法是将燃着的木条放在a处,熄灭则满。Ⅱ.(1)表中x 的数值应是2.0g. (2)表中的待测数据指 B.单位时间内产生氧气的质量. D.单位时间内产生氧气的体积.
(3)根据质量守恒定律知,生成氧气质量是50.0g+0.2g-48.4g=1.8g.
解∶设过氧化氢溶液中溶质质量为x
2H2O2![]() 2H2O+O2↑
2H2O+O2↑
68 32
x 1.8g
![]() =
=![]()
x=3.825gg
过氧化氢溶液中过氧化氢的质量分数为∶![]() ×100%=7.65%。
×100%=7.65%。
答∶过氧化氢溶液中过氧化氢的质量分数为7.65%。
点睛∶本题是一道实验探究题,主要考查实验室制取氧气的装置,原理,操作,收集等操作,并根据化学方程式进行计算。

【题目】酸溶液和碱溶液混合会发生怎样的变化呢?某班级同学开展如图1所示相关的实验.下面是两个小组的实验
记录与分析.请根据要求回答问题:
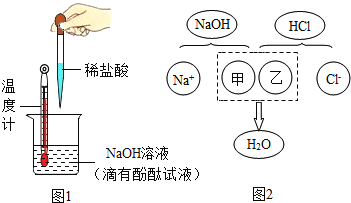
(1)甲组同学往一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸(室温下),反应中溶液温度的变化记录如下:
加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
溶液温度上升 (△t)/℃ | 5.6 | 9.8 | 12.1 | 16.3 | 18.5 | 17.1 | 15.2 | 14.6 | 13.5 | 12.6 |
根据上表数据分析:
①当加入盐酸体积为__mL时,表明NaOH与HCl恰好完全反应.此判断的依据是__.
②当加入6mL盐酸时,烧杯中溶液仍然呈红色,该溶液中含有的溶质有酚酞和__.
③教材指出:酸与碱中和反应的结果是酸和碱各自的特性都消失.图2描述的是氢氧化钠与盐酸反应的微观实质,请从微观的角度分析,甲、乙处应填入的化学符号依次是__、__.
(2)请你参与完成乙组同学的实验记录与分析.
实验操作 | 实验现象 | 分析与结论 |
步骤一:往装有氢氧化钠溶液样品的试管中先滴加2~3滴的 酚酞试液,再逐滴加入稀盐酸 | 现象一:有气泡产生 现象二:__ | 1.该氢氧化钠溶液样品已变质 2.溶液碱性消失 |
现象一:有气泡产生 现象二:溶液开始不变色,后逐渐变成红色 | 1.产生“气泡”这一现象对应的化学方程式为__ 2.所取的步骤一反应后的溶液pH__7(填“<”、“=”或“>”) |