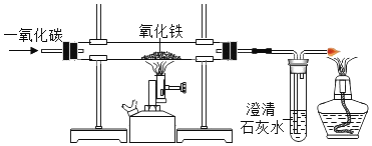
题目内容
【题目】欲配制50g质量分数为10%的氯化钠的溶液,操作过程如图所示,看图回答下列问题:
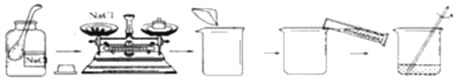
(1)称量时,应称取_____g 食盐。
(2)把水的密度近似地看作1g/mL,则须量取_____ mL水。如果有10mL、50mL和100mL的量筒,最好选取_____ mL的量筒。
(3)实验中使用玻璃棒的目的是_____。
(4)如果所配得的溶液溶质的质量分数比大于10%,你认为可能的原因有_____。
A.量取水时俯视读数
B.所用氯化钠中含有杂质
C.称量时左托盘放砝码,右托盘放氯化钠(1g以下用游码)
D.未溶解充分就转移到试剂瓶中
【答案】54550搅拌,加速溶解A
【解析】
根据“溶质的质量=溶液的质量×溶质的质量分数”计算配制溶液所需食盐的量;根据“溶剂的质量=溶液的质量﹣溶质的质量”计算出水的量并换算成体积,并根据“量程稍大于所量液体体积”的原则选择量筒;明白溶解时玻璃棒的作用,为加快溶解需要使用玻璃棒;根据导致溶液中氯化钠的质量分数大于10%的原因可能是:称量溶质称多了,量取水时量少了(量水时俯视读数)进行解答。
(1)食盐的质量=50g×10%=5g;
(2)水的质量=50g﹣5g=45g即45mL;需要量取45gmL水所以在“10mL、50mL和100mL的量筒”中选择最接近此体积的50mL的量筒;
(3)溶解操作中用玻璃棒进行搅拌,可以加快食盐的溶解,直到固体物质全部溶解;
(4)A、用量筒量取水时俯视读数,读数偏大,量取到的水偏小,溶质不变,溶剂偏小,溶质质量分数偏大;B、所用氯化钠中含有杂质则食盐偏小,溶质质量分数偏小;C、称量时左托盘放砝码,右托盘放氯化钠(1g以下用游码),实际质量是砝码减游码,溶质偏小,溶质质量分数偏小;D、未溶解充分就转移到试剂瓶中,则食盐偏小,溶质质量分数偏小。故选A。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究.
【提出问题】它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
【实验探究1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
查阅资料:
pH | 7.5~9 | 10~11.9 | 12~14 |
紫甘蓝汁液显示的颜色 | 蓝色 | 绿色 | 黄色 |
【得出结论1】三种溶液的碱性由强到弱的顺序为_____.
【实验探究2】甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由_____色变为_____色.向其中加入稀盐酸,该反应的化学方程式为_____.
乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示.
【得出结论2】从微观角度分析,该反应的实质是__________.
【实验探究3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得列pH变化与时间的关系如图2、图3所示.
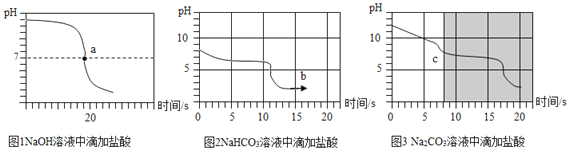
【交流与反思】b点的溶质为_____(写化学式),将图2和图3的阴影部分进行叠加,发现两者基本重合,c点的溶质_____(写化学式)
【得出结论3】通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示:_____________、____________.
【结论与反思】探究溶液的酸碱性及反应pH值的变化,可以认识反应的原理及进行的过程.