题目内容
【题目】(12分)以下是甲、乙两同学对有关镁与盐酸反应的系列研究。
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填
“吸热”或“放热”)。
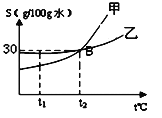
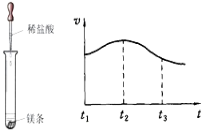
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,
则t1~t2时间内反应速率逐渐加快的主要原因是 。
研究二:反应后所得溶液的酸碱性探究:
(3)甲同学反应后用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶
液呈 性(选填“酸”“碱”或“中”)。
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。为
验证猜想,甲同学需测定 溶液的酸碱性,实验表明该溶液显弱酸性。
(4)乙同学重复甲同学实验时,发现反应后所得试管中溶液pH大于7。发现实验与甲同学实
验不同的是,反应后的试管中镁条有剩余。乙同学猜想可能是镁与热水反应生成了碱性
物质。乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶
液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,
请根据实验现象写出镁与水反应的化学反应方程式 。
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,则氯化钾溶液显 性。
(6)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由
此可见金属与水反应与金属的活动性顺序 (填“有关”或“无关”)。
研究三:金属活动性强弱与原子结构的关系:
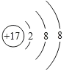
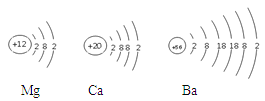
下图为镁原子、钙原子和钡原子结构示意图。已知其中Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与 有关。
研究四:确定镁条的成分:
称取3.2g表面被氧化的镁条, 放入100g稀盐酸中恰好完全反应,生成气体0.2g。求:
(7)此镁条中金属镁的质量。(写出计算过程,共3分)
(8)反应后所得溶液中溶质的质量分数 。(计算结果保留一位小数)
【答案】研究一:(1) 放热 (2) 镁与稀盐酸反应放热,加快反应速率
研究二:(3) 酸性 氯化镁 (4) Mg +2H2O === Mg(OH) 2↓+H2 ↑
(5)中性 (6)有关
研究三:电子层数
研究四: (7)m(Mg)=2.4g (8) 11.1%
【解析】
试题分析:研究一:(1) 反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应
(2) 实验测得镁片产生气体的速率(v)与时间(t)的关系如右图所示,则t1~t2时间内反应速率逐渐加快的主要原因是:镁与稀盐酸反应放热,加快反应速率
研究二:(3)用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈酸性;甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7,因为主要是因为溶液显酸性,所以只要测定氯化镁溶液的酸碱性,实验表明该溶液显弱酸性
(4)在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,,说明反应形成了一种碱,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,可以判断是氢气,所以镁与水反应的化学反应方程式:Mg +2H2O === Mg(OH) 2↓+H2 ↑
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,从中可以得出结论:金属的活动性越强,形成的金属氯化物溶液显中性,而钾的活动性比钠强,故氯化钾溶液显中性
(6)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。而金属镁要与热水反应,说明金属与水反应与金属的活动性顺序有关
研究三:金属镁的原子核外有3个电子层,金属钙的原子核外有4个电子层,金属钡的原子核外有6个电子层,而Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与电子层数有关
研究四:根据反应:Mg+ 2HCl === MgCl2 + H2↑中氢气与Mg的质量关系,即可求出镁的质量,还发生了一个反应:MgO+2HCl==MgCl2+H2O, 反应后所得溶液中溶质是MgCl2,先根据方程式,算出MgCl2的质量,再计算溶质的质量分数
解:设金属镁的质量为x,生成MgCl2的质量为y
Mg+ 2HCl === MgCl2 + H2↑
24 95 2
X y 0.2g
(7) 24:2=x:0.2g x=2.4g
95:2=y:0.2g y=9.5g
(8)由于MgO的质量=3.2g-2.4g=0.8g,设生成的MgCl2的质量为z
MgO+2HCl==MgCl2+H2O
95
0.8g z
40:95=0.8g:z z=1.9g
故MgCl2的质量的总质量=9.5g+1.9g=11.4g
而溶液的总质量=3.2g+100g-0.2g=103g
溶质的质量分数=11.4g/103g×100%=11.1%

 阅读快车系列答案
阅读快车系列答案