题目内容
(2009?天津)下表为KCl在不同温度下的溶解度| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
| 溶解度/g | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 |
(2)在10℃时,向100g水中加入40g KCl固体,充分混合后所得溶液为(填“饱和”或“不饱和”)溶液;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为(计算结果精确到0.1%).
(3)将60℃时145.5gKCl的饱和溶液降温到40℃,析出晶体的质量是g.
【答案】分析:(1)利用各温度对应的溶解度数值可判断氯化钾与温度的关系.
(2)利用10℃是氯化钾的溶解度分析溶液是否饱和,升温后再利用溶质的质量分数计算方法进行计算.
(3)利用60℃与40℃的溶解度通过计算解决析出晶体的问题.
解答:解:(1)由表中的数据可以看出氯化钾的溶解度随温度升高而增大,故答案为:增大
(2)10℃100g水中能溶解31g氯化钾,故加入40g溶质溶液会饱和且溶质会有剩余,升高到50℃100g水会溶解42.6g溶质,则40g溶质都会溶解,此使溶质的质量分数是: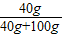 ×100%=28.6%
×100%=28.6%
故答案为:饱和;28.6%
(3)60℃时的溶解度是45.5g,故溶液的溶剂量是100g,降到40℃是能溶解40g氯化钾,故析出晶体的量是5.5g
故答案为:5.5
点评:此题是关于溶解度利用的知识考查题,是溶解度知识的深层次应用,解题时只要把握好溶解度的实质即可.
(2)利用10℃是氯化钾的溶解度分析溶液是否饱和,升温后再利用溶质的质量分数计算方法进行计算.
(3)利用60℃与40℃的溶解度通过计算解决析出晶体的问题.
解答:解:(1)由表中的数据可以看出氯化钾的溶解度随温度升高而增大,故答案为:增大
(2)10℃100g水中能溶解31g氯化钾,故加入40g溶质溶液会饱和且溶质会有剩余,升高到50℃100g水会溶解42.6g溶质,则40g溶质都会溶解,此使溶质的质量分数是:
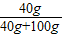 ×100%=28.6%
×100%=28.6%故答案为:饱和;28.6%
(3)60℃时的溶解度是45.5g,故溶液的溶剂量是100g,降到40℃是能溶解40g氯化钾,故析出晶体的量是5.5g
故答案为:5.5
点评:此题是关于溶解度利用的知识考查题,是溶解度知识的深层次应用,解题时只要把握好溶解度的实质即可.

练习册系列答案
相关题目
(2009?天津)下表中,除去物质所含杂质的方法正确的是( )
|
(2009?天津)下表中,除去物质所含杂质的方法正确的是( )
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | N2气体 | O2 | 将气体缓缓通过灼热的铜网 |
| B | CuO粉末 | C | 加入过量稀盐酸,充分反应 |
| C | NaCl溶液 | NaOH | 加入过量的稀盐酸 |
| D | KCl溶液 | CuCl2 | 加入氢氧化钠溶液至不再产生沉淀 |
(2009?天津)下表为KCl在不同温度下的溶解度
(1)由上表可推测KCl溶解度随温度的升高而(填“增大”或“减小”).
(2)在10℃时,向100g水中加入40g KCl固体,充分混合后所得溶液为(填“饱和”或“不饱和”)溶液;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为(计算结果精确到0.1%).
(3)将60℃时145.5gKCl的饱和溶液降温到40℃,析出晶体的质量是g.
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
| 溶解度/g | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 |
(2)在10℃时,向100g水中加入40g KCl固体,充分混合后所得溶液为(填“饱和”或“不饱和”)溶液;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为(计算结果精确到0.1%).
(3)将60℃时145.5gKCl的饱和溶液降温到40℃,析出晶体的质量是g.
(2009?天津)下表中,除去物质所含杂质的方法正确的是( )
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | N2气体 | O2 | 将气体缓缓通过灼热的铜网 |
| B | CuO粉末 | C | 加入过量稀盐酸,充分反应 |
| C | NaCl溶液 | NaOH | 加入过量的稀盐酸 |
| D | KCl溶液 | CuCl2 | 加入氢氧化钠溶液至不再产生沉淀 |