题目内容
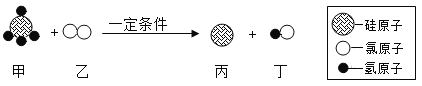
【题目】硅元素是元素周期表中第14号元素,从陶瓷,玻璃、水泥到电子芯片用途非常广泛。工业制取高纯硅的部分反应原理的微观示意图如下,请回答下列问题:
(1)画出硅原子的结构示意图_______________。
(2)甲物质中硅元素与氯元素的质量比是________________。(填最简整数比)
(3)上述反应的四种物质中属于单质的是__________________(选填“甲”、 “乙”、“丙”或“丁”)。
(4)该反应的化学方程式为______________该反应属于_______ (填基本反应类型)。
【答案】 14:71 乙、丙
14:71 乙、丙 ![]() 置换反应
置换反应
【解析】
(1)硅元素是元素周期表中第14号元素,硅原子核内有14个质子,核外有14个电子,根据核外电子排布规律可知,第1层上有2个电子,第2层上有8个电子,第3层有4个电子,硅原子的结构示意图; :
:
(2)根据微观示意图可知,甲的化学式为SiCl4,其中硅元素与氯元素的质量比是28:142=14:71;
(3)根据微观示意图可知,上述反应的四种物质分别为SiCl4、H2、Si、HCl,其中属于单质的是乙、丙;
(4)根据微观示意图可知,该反应是SiCl4、H2在一定条件下生成Si、HCl,化学方程式为![]() ,该反应是由一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应。
,该反应是由一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应。

【题目】2018年5月15日我国第一艘国产航母试海成功, 航母的许多电子原件都采用了黄铜(铜和锌的混合物,且铜不与硫酸反应)。为测定某黄铜中锌的质量分数,化学小组的同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 |
烧杯中剩余物质的质量/g | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的质量为________。
(2)第三次实验结束后溶液中的溶质为___________。
(3)该黄铜粉末中铜的质量分数是______?(写出计算过程)