题目内容
【题目】2018年5月15日我国第一艘国产航母试海成功, 航母的许多电子原件都采用了黄铜(铜和锌的混合物,且铜不与硫酸反应)。为测定某黄铜中锌的质量分数,化学小组的同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 |
烧杯中剩余物质的质量/g | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的质量为________。
(2)第三次实验结束后溶液中的溶质为___________。
(3)该黄铜粉末中铜的质量分数是______?(写出计算过程)
【答案】0.2g 硫酸锌和硫酸 67.5%(详见解析)
【解析】
(1)根据质量守恒定律可得,黄铜粉末完全反应生成氢气总质量为20g+80g-99.80g=0.2g,故填:0.2g;
(2)
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 |
反应前质量 | 40 | 59.92 | 79.84 | 99.80 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
质量变化 | 0.08 | 0.08 | 0.04 | 0 |
可见第三次时硫酸过量,此时的溶质为生成的硫酸锌和剩余的硫酸。
故填:硫酸锌和硫酸;
(3)设20克黄铜中铜的质量分数为x,
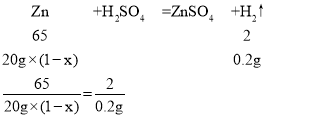
x=67.5%
答:该黄铜中铜的质量分数为67.5%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目