题目内容
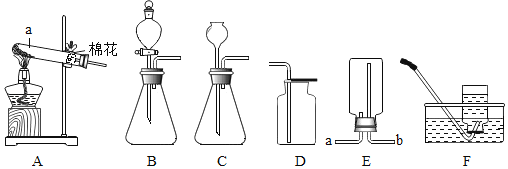
【题目】根据下列装置图,回答有关问题。
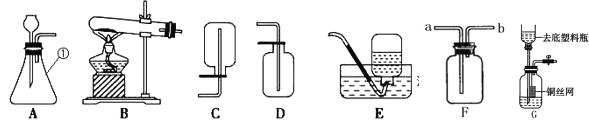
(1)仪器①的名称是_____________。
(2)实验室用氯酸钾和二氧化锰为原料制取氧气的发生装置应选_______(填装置序号),化学方程式为__________;若在F装置中装满水,用排水法来收集氧气,则氧气应从_________(填“a”或“b”)端进入。
(3)实验室制取二氧化碳的化学方程式为_______,收集二氧化碳用D装置的原因_______;图G是某同学利用塑料瓶和其他用品设计的制取二氧化碳的发生装置,该设计与A装置比较,除了废物利用的优点外,请另写一个优点____________。
(4)氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。
(阅读资料)①碱石灰是氧化钙和氢氧化钠的混合物;②钙遇水立即发生剧烈反应,生成氢氧化钙和氢气;
③氢化钙要密封保存,遇水反应,生成氢氧化钙和氢气。
(氢化钙的制备)氢化钙通常用氢气与钙加热制得,某化学兴趣小组设计的制取装置如下图所示(固定装置省略)。
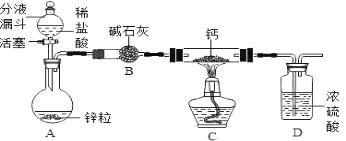
回答下列问题:
①装置A中制取氢气的化学方程式为________________。
②装置B的作用是____________。
③钙与水反应的化学方程式为_________,属于基本反应类型中的________反应。
【答案】锥形瓶 B 2KClO3![]() 2KCl+3O2↑ b CaCO3+2HCl===CaCl2+ H2O+ CO2↑ 二氧化碳密度比空气大 控制反应的发生与停止 Zn+2HCl===ZnCl2+ H2↑ 吸收水蒸气和氯化氢气体 Ca+2H2O===Ca(OH)2+2H2↑ 置换
2KCl+3O2↑ b CaCO3+2HCl===CaCl2+ H2O+ CO2↑ 二氧化碳密度比空气大 控制反应的发生与停止 Zn+2HCl===ZnCl2+ H2↑ 吸收水蒸气和氯化氢气体 Ca+2H2O===Ca(OH)2+2H2↑ 置换
【解析】
(1)仪器①的名称是锥形瓶;
(2)在加热的条件下,二氧化锰的催化作用下,氯酸钾分解为氯化钾和氧气,反应方程式为2KClO3![]() 2KCl+3O2↑;该反应属于固体加热型,选择装置B来制取,氧气的密度比水小,若在F装置中装满水,用排水法来收集氧气,则氧气应从b进入;
2KCl+3O2↑;该反应属于固体加热型,选择装置B来制取,氧气的密度比水小,若在F装置中装满水,用排水法来收集氧气,则氧气应从b进入;
(3)二氧化碳的实验室制法是用稀盐酸与大理石(或石灰石,其主要成分都是碳酸钙)反应来制取,反应的方程式为CaCO3+2HCl===CaCl2+ H2O+ CO2↑;二氧化碳的密度比空气大,所以可用向上排空气法来收集;图G发生装置,另一个优点是可以控制反应的开始与停止;
(4)①锌与盐酸反应生成氯化锌和氢气,反应方程式为:Zn+2HCl===ZnCl2+H2↑:
②碱石灰能与氯化氢气体反应,除去氯化氢气体,还可以吸收水分,所以装置B的作用是吸收水蒸气和氯化氢气体;
③钙与水反应生成氢氧化钙和氢气,反应方程式为:Ca+2H2O===Ca(OH)2+2H2↑,该反应是由单质与化合物反应生成新的单质与新的化合物,属于置换反应。

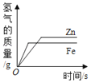
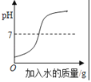
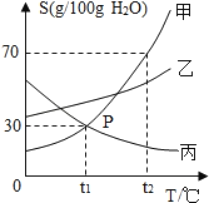
【题目】如表四个图像中,能正确反应对应变化关系的是
|
|
|
|
A.等质量的铁和锌与足量的稀盐酸反应 | B.向一定量的稀硫酸中加水稀释 | C.向一定量的稀盐酸中加大理石 | D.等质量、等浓度的过氧化氢溶液制氧气 |
A.A B.B C.C D.D
【题目】金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+B![]() A2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A的用量 | B的用量 | A2B的质量 | |
甲 | 7.0g | 1.0g | 5.0g |
乙 | 4.0g | 4.0g | 5.0g |
丙 | ag | bg | 3.0g |