题目内容
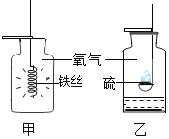
【题目】金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+B![]() A2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g。有关实验数据记录如下。试求丙学生实验中a:b的值可能是多少______?
A的用量 | B的用量 | A2B的质量 | |
甲 | 7.0g | 1.0g | 5.0g |
乙 | 4.0g | 4.0g | 5.0g |
丙 | ag | bg | 3.0g |
【答案】3:7或37:3。
【解析】
对比甲、乙两同学所用A和B的质量及生成A2B的质量:同样生成5.0gA2B,甲实验B的用量为1.0g、乙实验B的用量为4.0g,则可得反应生成5.0gA2B时需要消耗B的质量为1.0g;利用质量守恒定律,可判断生成5.0gA2B时消耗B的质量为1.0g,则消耗A的质量=5.0g-1.0g=4.0g,则两物质恰好完全反应时,A、B两物质的用量比为4:1;
根据反应中反应物A、B两物质的质量比为4:1及质量守恒定律,由于丙同学实验中生成A2B的质量3.0g,若A的用量=3.0g×![]() =2.4g,此时B的用量=8.0g-2.4g=5.6g;若B的用量=3.0g×
=2.4g,此时B的用量=8.0g-2.4g=5.6g;若B的用量=3.0g×![]() =0.6g,此时A的用量=8.0g-0.6g=7.4g;因此丙学生实验中a:b的值为2.4:5.6=3:7或7.4:0.6=37:3。
=0.6g,此时A的用量=8.0g-0.6g=7.4g;因此丙学生实验中a:b的值为2.4:5.6=3:7或7.4:0.6=37:3。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
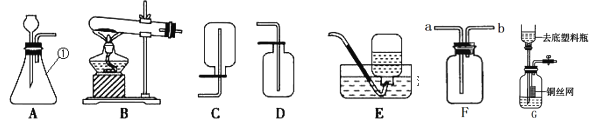
小学能力测试卷系列答案【题目】用如图所示装置可测定空气中氧气的含量。
(1)写出红磷燃烧的文字表达式_____,该反应属于_____(填“化合”或“分解”)。
(2)已知白磷、红磷等物质燃烧需要的最低含氧量如下:

可燃物名称 | 红磷 | 白磷 |
最低含氧量% | 8.0 | 4.0 |
白磷和红磷相比,使用白磷能使结果更准确,其原因是_____。
(实验拓展)某学习小组用右图装置进行镁条在空气中燃烧的实验。燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
(3)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的_____,现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中还一定有氮气,其理由是_____。
(4)通过以上实验探究,我们可以知道用于测定空气中氧气含量所选用的药品,应符合的条件是_____。