题目内容
将mg碳和铜的化合物放置在敞口容器中充分加热,完全反应后余下固体的质量仍为mg,则原混合物中碳的质量分数为( )
| A.30% | B.27% | C.20% | D.15.8% |
C
解析试题分析:碳和铜都被完全氧化后,冷却到室温,发现固体的质量没有变化,说明碳的质量等于和铜反应的氧气的质量;
设铜的质量为x,参加反应的氧气的质量为y;
2Cu+O2 2CuO
2CuO
128 32
x y
得: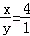
所以原混合物中铜粉与碳粉质量之比为4:1;
则原混合物中碳粉的质量分数为: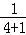 ×100%=20%.
×100%=20%.
故选C.
考点:根据化学反应方程式的计算.
点评:本题主要考查根据化学方程式计算方面的知识,本题解题的关键是通过审题找出:碳的质量等于和铜反应的氧气的质量,然后再根据化学方程式的进行计算.

练习册系列答案
相关题目
A和B可发生反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量之和都是12g。有关实验数据见下表,x︰y的值可能为
| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 10g | 2g | 6g |
| ② | 4g | 8g | 6g |
| ③ | xg | yg | 9g |
根据右图所提供的信息,下列对该袋食盐的判断不正确的是 
| A.该食盐中氯元素的质量分数最大 |
| B.每袋食盐中碘元素的质量为10 mg |
| C.每袋食盐中含碘酸钾的质量约为16.9 mg |
| D.若仅靠该盐补充碘,成人每天需摄入该食盐5 g |
有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如表所示:
| | 甲 | 乙 | 丙 |
| 金属混合物质量/g | 10 | 10 | 20 |
| 稀硫酸质量/g | 100 | 120 | 100 |
| 剩余固体质量/g | 4 | 4 | 13 |
请分析数据,回答下列问题:
(1)甲同学所得溶液中含有的溶质是 .
(2)计算丙同学所得溶液中溶质的质量分数.(计算结果精确到0.1%)
煅烧石灰石可制得氧化钙(假设石灰石中的杂质不参与反应,且不含钙、碳元素).测得煅烧后剩余固体中钙元素与碳元素的质量比为20:3.则已分解的碳酸钙占原碳酸钙的质量分数为( )
| A.40% | B.60% | C.30% | D.50% |
某兴趣小组的同学为了测定碳酸钠样品(只含有氯化钠,不含其它杂质)中碳酸钠的含量,取该混合物样品与适量稀盐酸恰好完全反应,有关实验数据见附表.
附表:实验数据
| | 反应前 | 反应后 | |||
| 实验数据 | 烧杯的质量/g | 稀盐酸的质量/g | 混合物样品的质量/g | 烧杯和其中混合物的质量/g | |
| 40.6 | 123.4 | 12 | 171.6 | | |
(2)样品碳酸钠的质量分数是多少?(最后结果保留到0.1%)
(3)反应后所得溶液的溶质质量分数是多少?
(7分)学过金属活动性后,秦思同学通过实验探究锌粉与硝酸亚铁和硝酸银两种盐溶液的反应。实验现象和数据如下: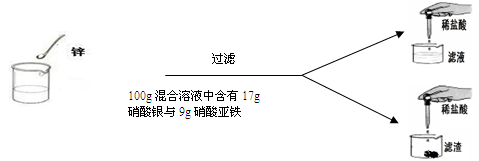
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 硝酸亚铁与硝酸银的混合溶液 | 100g | 100g | 100g | 100g |
| 锌粉 | 2g | 3.25g | m | 9.75g |
| 向滤液中加入稀盐酸后的实验现象 | 产生白色沉淀 | 无明显现象 | 无明显现象 | 无明显现象 |
| 向滤渣中加入100 g稀盐酸后的实验现象 | 无明显现象 | 无明显现象 | 产生气泡,溶液变为浅绿色 | 现象与第三次相同 |
(2)根据第一次的实验现象,你认为此次滤液中的溶质是 ;
(3)根据已知条件列出求解第二次实验中置换出金属银的质量(x)的比例式 ;
(4)若第三次实验锌与两种盐溶液恰好完全反应,则m的质量为__________________;
(5)若向第三次反应后的滤液中加入一定质量的水,所得不饱和溶液中溶质的质量分数为10%,则加入水的质量为__________________;
(6)若用溶质质量分数为36.5%的浓盐酸配制第四次实验中与滤渣恰好完全反应所需的稀盐酸,则需要浓盐酸与水的质量比为_______________。