题目内容
【题目】有一包固体粉末,可能含有铜、氧化铁、氯化钠、硫酸钠、硫酸铜中的一种或几种,为确定其成分进行如下实验,现象如图所示(部分生成物未标出):
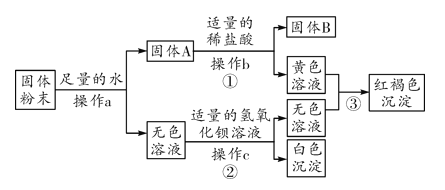
根据实验过程中的现象判断:
(1)固体B的成分是________(填化学式,下同);a、b、c含同一操作,其名称是________;
(2)固体粉末中一定不含有的物质是________,可能含有的物质是________;
(3)写出反应③的化学方程式________________________。
【答案】 Cu 过滤 CuSO4 NaCl FeCl3+3NaOH===Fe(OH)3↓+ 3NaCl
【解析】(1)硫酸铜在溶液中显蓝色,氧化铁和盐酸反应会生成黄色的氯化铁溶液,氯化铁和碱反应会生成红褐色的氢氧化铁沉淀,硫酸根离子和钡离子反应会生成白色的硫酸钡沉淀,固体粉末中加入足量的水溶解,得到固体A和无色溶液,所以固体粉末中一定不含硫酸铜,固体A加入足量的盐酸得到固体B和黄色溶液,所以B是铜,固体粉末中含有铜、氧化铁,无色溶液加入氢氧化钡会生成白色沉淀,所以固体粉末中一定含有硫酸钠,硫酸钠和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,所以,固体B的成分是C'u,a、b、c含同一操作,可以将不溶性固体从溶液中分离出来,其名称是过滤;(2)通过推导可知,固体粉末中一定不含有的物质是C'uSO4,可能含有的物质是NaC'l;(3)反应目是氢氧化钠和氯化铁反应生成氢氧化铁沉淀和氯化钠,化学方程式:FeCl3+3NaOH===Fe(OH)3↓+ 3NaCl。

【题目】物质通常是混合物,下列除杂方法正确的是( )
选项 | 物质(杂质) | 方法 |
A | H2O (MnO2) | 加热蒸干 |
B | CO (CO2) | 通入水中 |
C | CuO (C) | 氧气流中加热 |
D | CO2(CO) | 燃烧 |
A.AB.BC.CD.D