题目内容
【题目】亮亮同学做镁条在空气中燃烧的实验时,发现镁条燃烧除生成白色固体(MgO)外,还有少量的淡黄色固体生成。这种淡黄色固体是什么呢?亮亮在老师的指导下进行有关实验探究。
(实验探究)将该淡黄色固体投入到盛有水的烧杯中。
(实验现象)在烧杯中产生白色沉淀,并有刺激性的氨味气体产生。
(教师指导)上述反应产生的白色沉淀为Mg(OH)2 ,生成的气体为NH3 ;反应过程中没有任何元素化合价的改变。
(问题解决)此淡黄色固体中肯定含有镁元素和_______元素,判断的依据是_________;若该物质仅由两种元素组成,其化学式为_______。
(相关结论)空气中氮气(N2)和氧气(O2)的体积比约为_____,但镁条在空气中燃烧只生成少量的淡黄色固体,由此得出的一个结论是________
【答案】氮(N) 质量守恒定律 Mg3N2 4:1 氮气含量多但是很稳定,难以发生反应(合理说法都可以)
【解析】
(1)根据质量守恒定律,生成物中有氨气生成,故黄色固体中肯定含有镁元素和氮元素;
(2)该化合物中,金属元素镁显+2价,故氮元素只能先-3价,根据化合价的代数和为0,形成的化合物的化学式为:Mg3N2;
(3)空气中的主要成分是氮气和氧气,其中氮气占空气体积的![]() ,氧气占空气体积的
,氧气占空气体积的![]() ,故空气中氮气(N2)和氧气(O2)的体积比约为
,故空气中氮气(N2)和氧气(O2)的体积比约为![]() :
:![]() =4:1;氮气含量多但是很稳定,难以发生反应,主要与氧气发生反应生成氧化镁,故生成氮化镁的量较少。
=4:1;氮气含量多但是很稳定,难以发生反应,主要与氧气发生反应生成氧化镁,故生成氮化镁的量较少。

【题目】硫酸铜溶液能对过氧化氢的分解起催化作用.某小组拟在相同浓度硫酸铜溶液的催化下,探究硫酸铜对不同浓度过氧化氢溶液分解速率的影响.
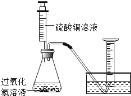
(1)分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的硫酸铜溶液,如图观察到产生气泡的速率不同,就可以粗略判断,得出实验结果.写出有关反应的化学方程式_____ ;
(2)为进一步判断上述实验结论的准确性,运用图,小刚同学进行了如下实验方案设计.
[方案一]在不同过氧化氢浓度下,测定收集相同气体体积所需时间.
[方案二]在不同过氧化氢浓度下,测定 ____________.
方案二的实验测量结果:
实验序号 物理量 | 过氧化氢溶液的浓度和体积 | 6%硫酸铜溶液的 体积(mL) | 反应的时间 (min) | 生成氧气的 体积(mL) |
1 | 8%10mL | x | 5 | V1 |
2 | 16%10mL | 3 | 5 | V2 |
表中x= _____.
实验结论:通过测量,若V1<V2,说明其它条件相同时, _________.
[继续探究]除了上述探究的影响反应速率的因素外,还有哪些因素可能会影响过氧化氢分解的反应速率?_______________(答一条即可)