题目内容
小亮在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是从厨房取适量小苏打样品进行了如下实验探究.
实验一:探究碳酸氢钠的化学性质
(1)取样品溶于适量的水中,测得溶液的pH大于7.于是作出判断NaHCO3溶液显(“酸性、碱性、中性”)______性.
(2)向小苏打样品中滴加盐酸,有大量气泡产生,经检验该气体是二氧化碳.该反应的化学方程式为______.
(3)若生成的CO2中混有少量的SO2为了除去SO2,现设计以下两种方法.
甲方法:将气体通过足量的碳酸氢钠溶液.
乙方法:将气体通过足量的氢氧化钠溶液.
【提供资料】:
Ⅰ. CO2与NaHCO3不会发生反应.
Ⅱ.SO2+2NaHCO3═Na2SO3++H2O+2CO2
Ⅲ.SO2+2NaOH═Na2SO3+H2O
请你利用提供的资料和所学的知识帮助小亮分析:
上述______方法(填“甲”或“乙”)可行,理由是______.
实验二:探究碳酸钠和碳酸氢钠的热稳定性
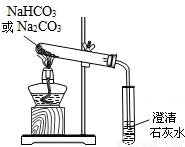
(4)小亮通过查阅资料,在老师的指导下采用如图的装置对纯碱和小苏打做了分别加热的对比实验(加热时间、加热温度相同).
加热纯碱时试管中的澄清石灰水无明显现象;
加热小苏打时试管中的澄清石灰水出现白色浑浊;
试回答:
①加热小苏打的化学反应方程式:______
②实验得出的结论是:______.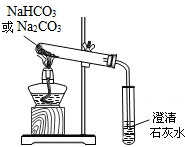
实验一:探究碳酸氢钠的化学性质
(1)取样品溶于适量的水中,测得溶液的pH大于7.于是作出判断NaHCO3溶液显(“酸性、碱性、中性”)______性.
(2)向小苏打样品中滴加盐酸,有大量气泡产生,经检验该气体是二氧化碳.该反应的化学方程式为______.
(3)若生成的CO2中混有少量的SO2为了除去SO2,现设计以下两种方法.
甲方法:将气体通过足量的碳酸氢钠溶液.
乙方法:将气体通过足量的氢氧化钠溶液.
【提供资料】:
Ⅰ. CO2与NaHCO3不会发生反应.
Ⅱ.SO2+2NaHCO3═Na2SO3++H2O+2CO2
Ⅲ.SO2+2NaOH═Na2SO3+H2O
请你利用提供的资料和所学的知识帮助小亮分析:
上述______方法(填“甲”或“乙”)可行,理由是______.
实验二:探究碳酸钠和碳酸氢钠的热稳定性
(4)小亮通过查阅资料,在老师的指导下采用如图的装置对纯碱和小苏打做了分别加热的对比实验(加热时间、加热温度相同).
加热纯碱时试管中的澄清石灰水无明显现象;
加热小苏打时试管中的澄清石灰水出现白色浑浊;
试回答:
①加热小苏打的化学反应方程式:______
②实验得出的结论是:______.

(1)溶液PH大于7为减性,PH=7为中性,PH小于7为酸性,所以碳酸钠溶液显碱性.
(2)小苏打与盐酸可发生复分解反应放出CO2气体,方程式为NaHCO3+HCl═NaCl+CO2↑+H2O
(3)根据信息知CO2与NaHCO3不会发生反应;SO2与NaHCO3能反应,不但能除去SO2,而且还能增加CO2的含量,所以甲同学的方案合理;
因为CO2、SO2都能与氢氧化钠溶液反应,方程式分别为SO2+2NaOH═Na2SO3+H2O;CO2+2NaOH═Na2CO3+H2O,所以乙同学的方案不合理.
(4)碳酸钠比较稳定,受热不易分解,而碳酸氢钠对热不稳定,受热分解2NaHCO3
Na2CO3+CO2↑+H2O,放出CO2,
CO2所以通入澄清石灰水变浑浊,方程式为Ca(OH)2+CO2=CaCO3↓+H2O
故填:(1)碱
(2)NaHCO3+HCl═NaCl+CO2↑+H2O
(3)甲 CO2与NaHCO3不会发生反应;SO2与NaHCO3能反应,不但能除去SO2,而且还能增加CO2的含量
(4)①2NaHCO3
Na2CO3+CO2↑+H2O
②碳酸氢钠受热会分解,碳酸钠受热不分解(或碳酸钠比碳酸氢钠稳定)
(2)小苏打与盐酸可发生复分解反应放出CO2气体,方程式为NaHCO3+HCl═NaCl+CO2↑+H2O
(3)根据信息知CO2与NaHCO3不会发生反应;SO2与NaHCO3能反应,不但能除去SO2,而且还能增加CO2的含量,所以甲同学的方案合理;
因为CO2、SO2都能与氢氧化钠溶液反应,方程式分别为SO2+2NaOH═Na2SO3+H2O;CO2+2NaOH═Na2CO3+H2O,所以乙同学的方案不合理.
(4)碳酸钠比较稳定,受热不易分解,而碳酸氢钠对热不稳定,受热分解2NaHCO3
| ||
CO2所以通入澄清石灰水变浑浊,方程式为Ca(OH)2+CO2=CaCO3↓+H2O
故填:(1)碱
(2)NaHCO3+HCl═NaCl+CO2↑+H2O
(3)甲 CO2与NaHCO3不会发生反应;SO2与NaHCO3能反应,不但能除去SO2,而且还能增加CO2的含量
(4)①2NaHCO3
| ||
②碳酸氢钠受热会分解,碳酸钠受热不分解(或碳酸钠比碳酸氢钠稳定)

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
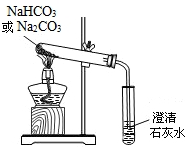 小亮在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是从厨房取适量小苏打样品进行了如下实验探究.
小亮在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是从厨房取适量小苏打样品进行了如下实验探究. 小亮在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是从厨房取适量小苏打样品进行了如下实验探究.
小亮在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是从厨房取适量小苏打样品进行了如下实验探究.