题目内容
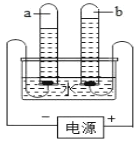
【题目】溶液在日常生活、工农业生产和科学研究中具有广泛的应用。下图是某同学在实验室配制氯化钠溶液的操作示意图,请结合相关知识,回答问题:
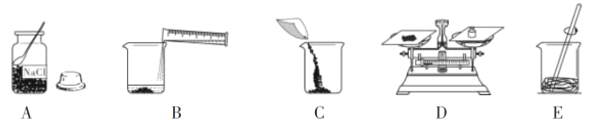
(1)欲配制100g溶质质量分数为10%的氯化钠溶液,完成此实验的正确操作顺序是_____(填序号)。
(2)已知20 °C时NaCl的溶解度是36g。该温度下,若将30 gNaCl放入50 g水中,充分溶解,溶液的溶质质量分数为_____,形成的是_____。(填“饱和”或“不饱和”)溶液。
【答案】ADCBE 26.5% 饱和
【解析】
饱和溶液是指在一定温度和压力下,溶剂中所溶解的溶质已达最大量(溶解度)的溶液。即溶质与溶剂接触时,溶解速度与析出速度相等的溶液。溶质的量未达到对应的饱和状态的溶液,称作不饱和溶液。
(1)配制100g溶质质量分数为10%的氯化钠溶液,先计算需要溶质和溶剂的体积,然后称量溶质的质量、量取溶剂的体积,再进行溶解,最后把配好的溶液装入细口瓶贴上标签储存,完成此实验的正确操作顺序是ADCBE。
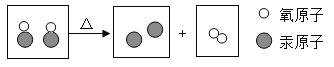
(2)20 °C时NaCl的溶解度是36g。该温度下,若将30 gNaCl放入50 g水中,充分溶解,溶液的溶质质量为![]() ,溶液的溶质质量分数为
,溶液的溶质质量分数为![]() ,30 gNaCl未溶解完,故形成的是饱和溶液。
,30 gNaCl未溶解完,故形成的是饱和溶液。

【题目】小李和小王同学对化学计算很有心得,以下是他们解答一道计算题的实录。请你一起参与研究并完成相关问题。( 计算结果精确到0.01g)
题目已知: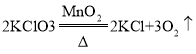 ,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:
,两位同学为了测定实验室中氯酸钾药品是否纯净,取2. 5g该药品与0. 5g二氧化锰混合。加热该混合物t3时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加t2 、t3、t4时间后剩余固体的质量,记录数据如下表:
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.12 | 2.08 | 2.04 | 2.04 |
(1)两同学一致认为氯酸钾已经完全反应的时间为_____(选填“t1”、 “t2”、“t3”、“t4”) 。
(2)小李根据质量守恒定律很快得到(2.5g+0.5g-2.04g)是_____(填化学式)的质量。
(3)请你计算:该药品中氯酸钾的质量,并判断该药品是否纯净?_____