题目内容
【题目】把干燥纯净的氯酸钾和二氧化锰混合物16克装入大试管后,给试管加热至完全反应后冷却称量,试管中固体物质质量为11.2克。请计算:
(1)氯酸钾中氧元素的质量分数是_____(保留一位小数);
(2)反应产生的氧气的质量是_____克;
(3)试管中残留固体物质有哪些?其质量各是多少?_____(写出计算过程)
【答案】39.2% 4.8 氯化钾和二氧化锰;氯化钾的质量为7.45g,二氧化锰的质量为3.75g
【解析】
(1)根据氯酸钾(KClO3)的化学式可知,氯酸钾中氧元素的质量分数=![]() ;
;
(2)依题意可知完全反应后生成氧气的质量为:16g-11.2g=4.8g;
(3)氯酸钾在二氧化锰的催化下,反应生成氯化钾和氧气,完全反应后残留固体物质有催化剂二氧化锰和反应生成的氯化钾;
设反应后混合物中KCl的质量为x,
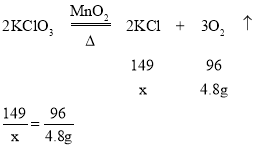
x=7.45g,则二氧化锰的质量为11.2g-7.45=3.75g,
答:(1)氯酸钾中氧元素的质量分数约为39.2%;
(2)反应产生的氧气的质量4.8g克;
(3)试管中残留的固体物质有氯化钾和二氧化锰,其中氯化钾的质量为7.45g,二氧化锰的质量为3.75g。

练习册系列答案
相关题目
【题目】某课外兴趣小组为了测定当地石灰石中CaCO3的质量分数,取25g石灰石样品,粉碎后,将100g一定质量分数的稀盐酸分5次加入到该样品中,所测数据如下表所示(杂质不与稀盐酸反应,也不溶于水):
次数 | 一 | 二 | 三 | 四 | 五 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
产生气体的质量/g | 2.2 | 4.4 | 6.6 | 8.8 | 8.8 |
(1)生成CO2的质量为_________g;
(2)第__________次恰好完全反应;
(3)求石灰石样品中CaCO3的质量分数。_________