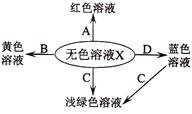
题目内容
某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品,反应的化学方程式为:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑。某研究性学习兴趣小组对该厂生产的烧碱样品进行如下探究。
2NaOH+H2↑+Cl2↑。某研究性学习兴趣小组对该厂生产的烧碱样品进行如下探究。
[提出问题]:烧碱样品中含有哪些杂质?
[猜想]:
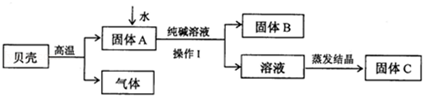
(1)可能含有NaCl,作出此猜想的依据是电解的过程中氯化钠没有完全反应。
(2)可能含有碳酸钠,做出此猜想的理由是 (用化学方程式表示)。
[实验设计]
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量的烧碱样品置于试管中加水溶解,用手触摸试管外壁。 | 试管外壁发热。 | 原因是 |
| ②向①所得的溶液中加入盐酸至过量。 | 开始时无明显现象,过一段时间后有气泡产生。 | 说明样品中含有杂质 |
| ③向②所得的溶液中加入硝酸银溶液。 | 有白色沉淀产生。 | AgNO3+NaCl=AgCl↓+NaNO3 说明样品中含有杂质氯化钠 |
[反思]:小明认为上述实验不能说明样品中含有氯化钠,理由是 。
【猜想】2NaOH+CO2=Na2CO3+H2O
【实验设计】①氢氧化钠溶于水时放出热量,②Na2CO3
【反思】在步骤②中加入盐酸时引入了氯离子
解析试题分析:[猜想]:二氧化碳与氢氧化钠反应生成碳酸钠和水,因此可能有碳酸钠;氯化钠可能没有全部反应,因此可能有氯化钠;故答案为:CO2+2NaOH=Na2CO3+H2O。
[实验设计]加水溶解,试管外壁发热,原因是氢氧化钠固体溶于水放热;向①所得的溶液中逐渐加入稀硝酸至过量,一开始无明显现象,一段时间后产生能使澄清石灰水浑浊的气体,因此样品中含有的杂质是碳酸钠;向②所得的溶液中滴加几滴硝酸银溶液,产生白色沉淀氯化银,说明样品中还含有的杂质是氯化钠;
[反思]:小明认为上述实验不能说明样品中含有氯化钠,因为第②步中加入的盐酸过量,盐酸中有氯离子,影响氯化钠中氯离子的检验。
考点:考查实验探究物质的组成成分以及含量;证明碳酸盐;碱的化学性质;书写化学方程式

(7分)目前,废旧电池对环境的污染已越来越引起人们的重视。为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用
技术。右图为普通电池(锌锰电池)示意图,请你根据图示
分析回答:
(1)废旧电池内含有的一种有机物名称是 ____。
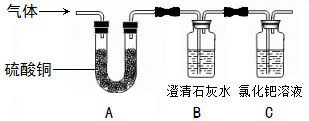
(2)小李同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶
液,并检验氯化铵中的铵根离子。设计了如下实验,
请回答:
实验①玻璃棒的作用是
实验②过滤后,滤液仍然浑浊,则造成浑浊的原因可能 (填编号)
| A.滤纸破损 | B.过滤过程中滤液的液面超过了滤纸的边缘 |
| C.烧杯不干净 | D.滤液C中的物质相互反应 |
实验④的反应方程式
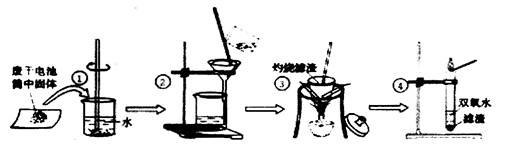
(3)氯化铵中的铵根离子检验方法:用小试管取少量滤液,滴加氢氧化钠溶液,微热,用 试纸放在试管口,如果变蓝,则证明滤液中含有铵根离子。反应方程式为
为了探究酸碱性对唾液淀粉酶催化作用的影响,小明利用蒸馏水、1%淀粉溶液、稀释的唾液、稀盐酸、氢氧化钠溶液、碘液等材料进行实验.请你完成相应的实验设计和问题分析.
【实验设计】
| 实验操作 | 设计要求 |
| 步骤一:取3 支洁净的试管标为A、B、c,在各试管中分别加入1%淀粉溶液2毫升;向A 试管加入l 毫升稀盐酸和l 毫升唾液;向B试管加入1 毫升氢氧化钠溶液和1 毫升唾液;向C试管加入 | 设置对照实验 |
| 步骤二: | 控制实验条件 |
| 步骤三:10分钟后,往3支试管中分别滴入1滴碘液,观察颜色变化. | 获取实验证据 |
【问题与分析】
正确操作后,小明观察到A试管呈蓝色,而B试管没有出现预期的蓝色.他想:为什么B试管不呈蓝色?他推测可能是氢氧化钠溶液变质或者B试管中液体碱性太弱.在老师的帮助下,他证实了氢氧化钠溶液没有变质,且B试管中液体碱性强度足以抑制酶的催化作用.请你对B试管没有出现蓝色作出一种合理的猜测: .