题目内容
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小滨同学设计了实验,以探究碳酸氢钠的化学性质.
【探究实验1】碳酸氢钠溶液的酸碱性
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞实验,震荡.
现象:溶液变成浅红色.由此得出结论 ;
【探究实验2】能与酸反应
【实验方案】取少量该固体加入试管中,滴加稀盐酸,现象为 ;
【探究实验3】碳酸氢钠的热稳定性
【实验方案】用如图所示装置进行实验
现象:充分加热后,大试管口有. 出现,管底有白色固体残留,
小试管中的现象. .
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).
(2)写出碳酸氢钠受热分解的化学方程式 ;
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途 .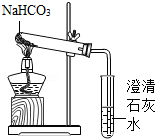
【探究实验1】碳酸氢钠溶液的酸碱性
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞实验,震荡.
现象:溶液变成浅红色.由此得出结论 ;
【探究实验2】能与酸反应
【实验方案】取少量该固体加入试管中,滴加稀盐酸,现象为 ;
【探究实验3】碳酸氢钠的热稳定性
【实验方案】用如图所示装置进行实验
现象:充分加热后,大试管口有. 出现,管底有白色固体残留,
小试管中的现象. .
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).
| 步骤 | 现象 | 结论 |
| 取样于试管中,往试管中滴加 | | |
(2)写出碳酸氢钠受热分解的化学方程式 ;
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途 .

(1)碳酸氢钠溶液的呈碱性 产生气泡 水珠 澄清石灰水变浑浊
NaHCO3 Na2CO3+CO2↑+H2O 焙制糕点或治疗胃酸过多
Na2CO3+CO2↑+H2O 焙制糕点或治疗胃酸过多
| 步骤 | 现象 | 结论 |
| 取样于试管中,往试管中滴加 稀盐酸 | 有气泡产生 | 留下的白色固体是Na2CO3 |
NaHCO3
 Na2CO3+CO2↑+H2O 焙制糕点或治疗胃酸过多
Na2CO3+CO2↑+H2O 焙制糕点或治疗胃酸过多试题分析:(1)碱或碱性溶液使紫色石蕊试液变蓝色,使无色酚酞试液变红色,溶液变成浅红色.由此得出结论碳酸氢钠溶液的呈碱性
(2)碳酸氢钠能与盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑,产生二氧化碳气体,所以有气泡
(3)结论告诉我们:碳酸氢钠受热能生成二氧化碳、水和一种白色固体,所以充分加热后,大试管口有水珠或水滴出现,由于产生了二氧化碳,小试管中的澄清石灰水变浑浊
(4)要证明是Na2CO3,而不是NaOH,那就应该抓住两者化学性质的不同,所以可用稀盐酸(或澄清石灰水、氯化钙溶液),若加入稀盐酸,Na2CO3会稀盐酸反应,产生气泡,而NaOH虽然也会与稀盐酸反应,但没有现象,若加入澄清石灰水或氯化钙溶液,Na2CO3会澄清石灰水或氯化钙溶液反应,均产生白色沉淀碳酸钙,而NaOH则不会反应,
(5)碳酸氢钠受热分解的化学方程式:NaHCO3 △Na2CO3+CO2↑+H2O, 碳酸氢钠在日常生活中的一种用途焙制糕点或治疗胃酸过多3、Na2CO3和NaOH化学性质,

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目