题目内容
【题目】某实验小组将63.2g高锰酸钾固体加热分解,并测得剩余固体的质量变化和加热 时间关系如下图所示:请认真分析图像,回答下列问题:
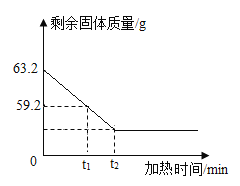
(1)加热到t1分钟 时,高锰酸钾是否完全分解:_____(填"是"或"否")。
(2)加热到t1分钟 时,产生氧气的质量是_____g。
(3)加热到t2分钟时,剩余固体中有哪些物质_____?质量分别是_____?(写出必要计算过程)
【答案】否 4.0g 剩余固体中有K2MnO4,MnO2 剩余固体中有K2MnO4,MnO2,质量分别是39.4g,17.4g
【解析】
(1)由图可知,加热到t1分钟时,高锰酸钾未完全分解,因为剩余固体的质量还在减少,故填否;
(2)加热到t1分钟时,根据质量守恒定律,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,产生氧气的质量是:63.2g-59.2g=4.0g;
(3)由图可知,加热到t2分钟时,高锰酸钾已经完全分解,故剩余固体为锰酸钾(K2MnO4)和二氧化锰(MnO2);
设生成的K2MnO4质量为x,MnO2质量为y

![]() ,
,![]()
x=39.4g,y=17.4g
答:剩余固体中有K2MnO4,MnO2,质量分别是39.4g,174g。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】一个密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得数据见下表。下列说法中正确的是(______)
甲 | 乙 | 丙 | 丁 | |
反应前的质量/g | 8 | 35 | 5 | 8 |
反应后的质量/g | 2 | X | 5 | 42 |
A. X=7 B. 在该反应中,甲、乙、丁的化学计量数之比为3:14:17
C.在该反应中,丙物质一定是催化剂 D.该反应的基本反应类型是______