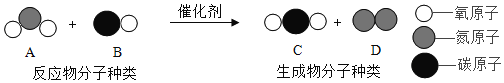
题目内容
【题目】我国著名化学家侯德榜发明的“联合制碱法”主要原理是:
Ⅰ.向浓氨水中通入足量的CO2,使氨气、水和CO2发生化合反应而生成NH4HCO3溶液;
Ⅱ.向所得溶液中加入食盐细粒,充分搅拌,会析出溶解度较小的小苏打固体并得到化肥溶液;
Ⅲ.加热析出的固体制取纯碱。
此法经过调整并应用于化工产业,某化工企业的工艺流程示意图如下,请完成下列填空:
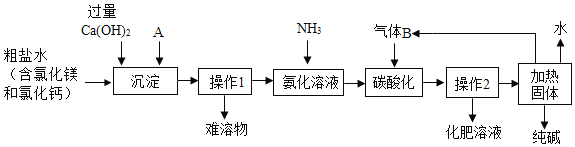
(1)“联合制碱法”原理Ⅱ中发生反应的化学方程式为______,该反应能够发生的原因是______。
(2)在如图所示的流程中,先加过量的Ca(OH)2溶液是为了除去______离子(写符号),再加入A溶液的化学式是______,两种溶液加入的先后顺序能否颠倒?说明理由______。
(3)“操作1”需用的玻璃仪器有______,“氨化溶液”后,溶液的pH______7(填“大于”、“小于”或“等于”),从而有利于吸收“气体B”。
(4)该工艺流程中可循环利用的物质为______。
【答案】NH3+NaCl+CO2+H2O=NaHCO3↓+NH4Cl 碳酸氢钠溶解度比较小,会形成晶体析出 Mg2+ Na2CO3 不能颠倒,否则溶液中会含有氢氧化钙(合理即给分) 烧杯、漏斗、玻璃棒 大于 CO2
【解析】
(1)“联合制碱法”原理Ⅱ中发生反应是氯化钠、水、二氧化碳和氨气反应生成氯化铵和碳酸氢钠,故反应的化学方程式写为:NH3+NaCl+CO2+H2O=NaHCO3↓+NH4Cl;
此时碳酸氢钠溶解度比较小,会形成晶体析出,促进了反应的发生,故填碳酸氢钠溶解度比较小,会形成晶体析出。
(2)加入的氢氧化钙能与氯化镁反应生成氢氧化镁沉淀和氯化钙,通过反应将溶液中的镁离子转化为沉淀,从而除去镁离子,故填Mg2+;
加入的碳酸钠能与氯化钙和过量的氢氧化钙反应生成碳酸钙沉淀而除去钙离子,碳酸钠的化学式为Na2CO3,故填Na2CO3;
氢氧化钙和碳酸钠溶液的加入的先后顺序不能颠倒,否则溶液中会混有氢氧化钙,故填不能颠倒,否则溶液中会含有氢氧化钙(合理即给分)。
(3)经过操作Ⅰ得到了沉淀,所以该操作是过滤,需要的玻璃仪器有烧杯、漏斗、玻璃棒,故填烧杯、漏斗、玻璃棒;
氨化后的溶液呈碱性,pH大于7,有利于吸收的气体是二氧化碳,故填大于。
(4)由流程图可知,流程中可循环利用的物质是碳酸氢钠分解生成的二氧化碳,故填CO2。