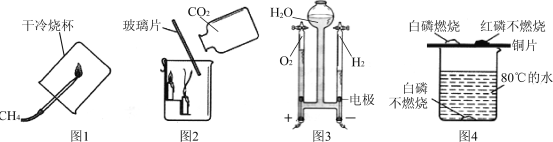
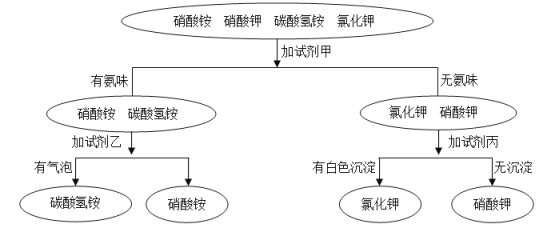
题目内容
【题目】甲、乙是初中化学常见的物质,它们与氧气之间存在如下图所示的反应关系(“—”表示物质间相互反应,“→”表示物质间转化,部分反应物、生成物及反应条件略去)。
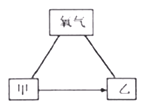
(1)若甲是一种黑色的固态非金属单质,乙是一种氧化物。
①甲的化学式为______。②乙与氧气反应的基本类型是_________。
(2)若甲、乙均为金属单质,且乙呈紫红色。
①乙在生活中的一种用途是________。
②“甲→乙”的化学方程式为_______________。
③用稀硫酸代替氧气,上图所示反应关系不能成立,原因是____________。
【答案】 C 化合反应 作导线 Fe+CuSO4=FeSO4+Cu 乙不能与硫酸(稀)发生反应
【解析】根据甲、乙是初中化学常见的物质,根据“甲是一种黑色的固态非金属单质,乙是一种氧化物”,初中常见的黑色物质有石墨、四氧化三铁、二氧化锰、铁粉、氧化铜。由此可知甲可能为碳、乙为一氧化碳;根据“若甲、乙均为金属单质,且乙呈紫红色”,则推测乙为铜,甲为比铜活泼的金属,例如铁,代入检验正确。(1)若甲是一种黑色的固态非金属单质,乙是一种氧化物,则甲可能为碳、乙为一氧化碳,故:①甲的化学式为C,②乙(一氧化碳)与氧气反应生成二氧化碳的基本类型是化合反应;(2)若甲、乙均为金属单质。且乙呈紫红色,则推测乙为铜,甲为铁,故:①乙在生活中的一种用途是作导线;②“甲→乙”为铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu;③用稀硫酸代替氧气,如图所示反应关系不能成立,原因是乙不能与稀硫酸发生反应。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,某同学称取m g的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀盐酸质量(g) | 10 | 10 | 10 | 10 |
剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
(1)通过计算确定m的值为__________。
(2)铜锌合金中铜的质量分数为多少_________?(写出(1)、(2)计算过程)
(3)求所用稀盐酸中溶质的质量分数__________。(写出计算过程)
【题目】控制变量,设计对比实验是实验探究的重要方法。
实验一:区分硬水和软水。
| 本实验条件除了要控制所取硬、软水的体积相同外,还必须要控制___________相同。 |
实验二:探究人体吸入的空气与呼出的气体有什么不同。
| 将燃着的小木条分别插入空气样品和呼出气体的样品中,对比观察到的现象,可以得出的结论是___________。 |
实验三:探究决定氯化铁溶液颜色的粒子。
| 氯化铁溶液呈黄色。为了探究溶液中的哪种粒子使溶液呈黄色,小艳同学分析溶液中存在的粒子,选择了一种试剂作对比,确定了决定氯化铁溶液颜色粒子,用作对比的试剂可以是___________溶液。 |