题目内容
【题目】“联合制碱法”的化学方程式为:NaCl+H2O+NH3+CO2═X↓+NH4Cl,X的化学式为________;一定条件下,2.3g乙醇与4.0gO2恰好完全反应,生成2.7gH2O、2.2gCO2和物质Y,则Y的质量为________;Y的化学式为 ________
【答案】NaHCO3;1.4g;CO
【解析】
反应的化学方程式NaCl+H2O+NH3+CO2═X↓+NH4Cl,可知可知反应前各原子个数为:
反应前 反应后
Na原子 1 0
Cl原子 1 1
N原子 1 1
H原子5 4
C原子 1 0
O原子 3 0
根据反应前后原子种类、数目不变,可判断生成物X的一个分子由1个钠原子、1个H原子、1个C原子、3个O原子构成,因此可确定物质X的化学式可表示为NaHCO3;根据反应前后质量总和不变列等式:2.3g+4.0g=2.7g+2.2g+Y,解得Y=1.4g;2.3g乙醇中碳、氢、氧三种元素的质量分别为:1.2g、0.3g、0.8g;2.7gH2O中氢氧两种元素的质量分别为:0.3、2.4g;2.2gCO2中碳氧元素的质量分别是0.6g、1.6g,则Y中含有碳氧元素,质量分别为0.6g、0.8g,原子个数比为![]() :
:![]() =1:1,因此Y是一氧化碳。
=1:1,因此Y是一氧化碳。

 阅读快车系列答案
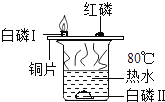
阅读快车系列答案【题目】空气是一种宝贵的自然资源。某兴趣小组的同学在实验室欲用下图所示装置粗略测定空气中氧气的含量。
(实验回顾)
(1)写出红磷燃烧的文字表达式:____________。
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内____________减小,烧杯中水倒吸到集气瓶。若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。
(提出问题)有实验资料表明:燃烧过程中当氧气体积分数低于7% 时,红磷就无法继续燃烧,因此通过上述实验,测定结果与理论值误差较大。那么,能否设计一套实验装置使测定结果更为准确呢?
(查阅资料)铁生锈的原理是:铁与空气中的氧气和水蒸气等发生化学反应。饱和食盐水、活性炭会加速铁生锈。
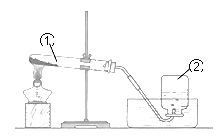
(实验改进)方案一:Ⅰ.同学们根据铁在空气中生锈的原理设计如图的实验装置,再次测定空气中氧气含量。

Ⅱ.测得实验数据如下表:
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的体积 | |
体积/ml | 80.0 | 54.5 | 126.0 |
(交流表达)
(3)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:①_______________;②____________。
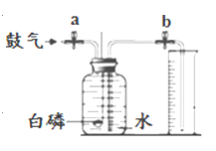
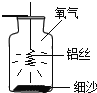
方案二:同学们又设计了下图所示的实验装置,实验步骤如下(装置气密性良好,部分操作已略去):
Ⅰ.打开止水夹a和b,向集气瓶中缓慢鼓入一定量空气,至白磷与空气接触,测得进入量筒中水的体积为V1;II.关闭a和b强光照射引燃白磷;III.白磷熄灭并冷却至室温,打开止水夹b测得量筒中水的体积变为V2;IV.计算空气中氧气的体积分数。步骤IV中,求得氧气的体积分数等于___。