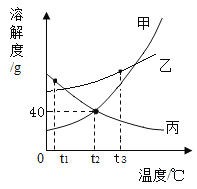
题目内容
【题目】某水溶液中含有以下离子中的若干种:![]() ,现取两份溶液各100ml,分别进行如下实验:
,现取两份溶液各100ml,分别进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成;
(2)第二份加足量BaCl2溶液后,得沉淀物6.63g,经足量硝酸洗涤、干燥后,沉淀质量为4.66g;在所得滤液中加入AgNO3溶液有溶液生成。
根据上述实验,回答下列问题。
(1)写出第(2)步中生成沉淀的反应方程式:______________________。
(2)根据第(1)(2)步实验操作判断原溶液中__________![]() 。(填“肯定有”、“肯定无”、“可能有”)
。(填“肯定有”、“肯定无”、“可能有”)
(3)原溶液中![]() 和
和![]() 的个数比为__________________。
的个数比为__________________。
(4)原溶液中![]() 的离子:________________________。
的离子:________________________。
【答案】BaCl2+K2SO4═BaSO4↓+2KCl、BaCl2+K2CO3═BaCO3↓+2KCl 可能有 1:2 Ca2+
【解析】
第一份加入AgNO3溶液有沉淀产生,白色沉淀可能为碳酸银、硫酸银、氯化银,说明溶液中可能存在Cl-、CO32-、SO42-;
第二份加足量BaCl2溶液后,得沉淀物6.63g,经足量硝酸洗涤、干燥后,沉淀质量为4.66g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而Ca2+和CO32-不共存,所以没有Ca2+;由电荷守恒可知,一定有阳离子为K+,所得滤液中加入AgNO3溶液有沉淀产生,沉淀为AgCl,但加氯化钡引入氯离子,综上可知溶液中一定有CO32-和SO42-,可能有Cl-,一定没有Ca2+。
(1)溶液中一定含有的阳离子是钾离子,故第(2)步中生成沉淀的反应是氯化钡和硫酸钾反应生成硫酸钡沉淀和氯化钾,氯化钡和碳酸钾反应生成碳酸钡沉淀和氯化钾,故填:BaCl2+K2SO4═BaSO4↓+2KCl、BaCl2+K2CO3═BaCO3↓+2KCl;
(2)根据第(1)(2)步实验操作判断原溶液中氯离子可能有;
(3)一定有![]() 和
和![]() ,且二者的个数比为
,且二者的个数比为![]() :
:![]() =1:2;
=1:2;
(4)原溶液中肯定没有Ca2+。