题目内容
某课外小组欲测定某石灰石样品中碳酸钙的质量分数,进行了以下实验:
①称取该样品10g.
②加入足量的稀盐酸充分反应(样品中杂质不与盐酸反应);
③将所生成的全部气体除杂干燥后,通入100g氢氧化钠浓溶液,反应后称得此溶液总质量为102.2g.
请计算:该石灰石样品中碳酸钙的质量分数是多少?
解:根据实验③可知m(CO2)=102.2g-100g=2.2g,
设样品中CaCO3的质量为xg,则
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g
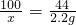
解得x=5g,
即样品中碳酸钙的质量为5g,
则样品中ω(CaCO3)=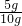 ×100%=50%,
×100%=50%,
答:该石灰石样品中碳酸钙的质量分数是50%.
分析:根据二氧化碳与氢氧化钠浓溶液反应,溶液增重的质量为二氧化碳的质量,然后利用碳酸钙和盐酸反应的化学方程式来计算碳酸钙的质量,最后计算样品中碳酸钙的质量分数.
点评:本题考查学生利用化学反应方程式的计算,学生能利用实验③确定二氧化碳的质量是解答的关键,然后代入方程式计算即可.
设样品中CaCO3的质量为xg,则
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g
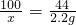
解得x=5g,
即样品中碳酸钙的质量为5g,
则样品中ω(CaCO3)=
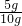 ×100%=50%,
×100%=50%,答:该石灰石样品中碳酸钙的质量分数是50%.
分析:根据二氧化碳与氢氧化钠浓溶液反应,溶液增重的质量为二氧化碳的质量,然后利用碳酸钙和盐酸反应的化学方程式来计算碳酸钙的质量,最后计算样品中碳酸钙的质量分数.
点评:本题考查学生利用化学反应方程式的计算,学生能利用实验③确定二氧化碳的质量是解答的关键,然后代入方程式计算即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某实验小组欲测定某白色粉末(已知是碳酸钠与碳酸氢钠的混合物)的组成,取三份质量不同的样品甲、乙、丙分别与30g稀盐酸充分反应,得到的常温常压下气体体积关系如下表,试求:
(1)样品中碳酸钠的质量分数?
(2)稀盐酸的质量分数?(已知二氧化碳常温常压下的密度是1.97g/L)(计算过程中保留两位小数)
(1)样品中碳酸钠的质量分数?
(2)稀盐酸的质量分数?(已知二氧化碳常温常压下的密度是1.97g/L)(计算过程中保留两位小数)
| 甲 | 乙 | 丙 | 混合物质量/g | 3.80 | 7.60 | 11.4 | 二氧化碳的体积/L | 0.893 | 1.786 | 1.786 |