题目内容
【题目】认真分析下列各图,回答相关问题: 
(1)根据图1分析,20℃时,将20g NaCl加入50g水中形成溶液的质量为 .
(2)图2中打开汽水瓶冒出大量气泡,说明气体的溶解度与有关.
(3)在图3所示的烧杯中加入一定量的硝酸铵,溶解后甲试管内出现的现象是;乙试管内的溶液是(填“饱和”或“不饱和”)溶液.
【答案】
(1)68g
(2)压强
(3)有晶体析出;不饱和
【解析】解:(1)20℃时氯化钠的溶解度 是36g,即20℃时100g水中最多溶解36g氯化钠,故将20g NaCl加入50g水中最多溶解18g,形成溶液的质量为68g;(2)打开汽水瓶冒出大量气泡,说明气体的溶解度随压强的减小而减小;(3)硝酸铵溶于水使溶液温度降低,硝酸钾的溶解度随温度的降低而减小,氢氧化钙的溶解度随温度的降低而增大;故加入一定量的硝酸铵,溶解后甲试管内有硝酸钾晶体析出,乙试管变为不饱和溶液;所以答案是:(1)68g; (2)压强; (3)有晶体析出;不饱和.
【考点精析】掌握溶解时的吸热或放热现象和固体溶解度曲线及其作用是解答本题的根本,需要知道溶解时放热、吸热现象<溶解吸热:如NH4NO3溶解;溶解放热:如NaOH溶解、浓H2SO4溶解;解没有明显热现象:如NaCl>;1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】(7分)实验室里有一瓶常用的无色溶液,因保管不当,其残缺的标签中只剩下“Na”和“10%”字样(如图所示).
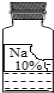
小强和小华同学很感兴趣,决定对其成分进行探究.
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 ( )
A.酸B.碱C.盐
【查阅资料】
Ⅰ初中常见含钠的化合物有:NaCl、NaOH、Na2CO3、NaHCO3.
ⅡNa2CO3和NaHCO3的水溶液都呈碱性.
Ⅲ室温(20℃)时,测定四种物质的溶解度数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度g | 36 | 109 | 215 | 9.6 |
小华根据试剂瓶标注的质量分数为10%和上表中的溶解度数据判断,这瓶试剂不可能是
【作出猜想】①可能是NaCl;②可能是Na2CO3;③可能是
【实验探究】
(1)小强用洁净的玻璃棒蘸取试液于pH试纸上,测得pH>7,则这瓶试剂不可能是
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验.
实验步骤 | 实验现象 | 结论及化学方程式 |
取少量溶液于试管中,滴加 | 产生大量气泡 | 反应的化学方程式: |
把产生的气体通入澄清的石灰水中. | 澄清的石灰水变浑浊 | 猜想②正确. 反应的化学方程式: |