题目内容
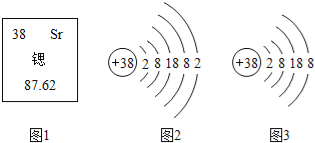
【题目】请根据如图提供的实验装置(部分铁架台、铁夹略)回答有关问题。
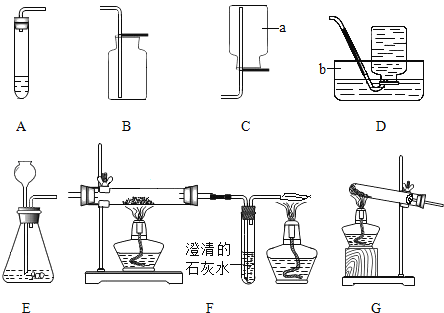
(1)实验室利用过氧化氢溶液和二氧化锰制氧气,发生反应的化学方程式为_____,如果改用高锰酸钾制氧气,发生反应的化学方程式为_____,所使用制气发生装置为(填代号,下同)_____,收集装置为_____。
(2)实验室制取二氧化碳,发生反应的化学方程式为_____,实验装置为_____。
(3)实验室用一氧化碳还原四氧化三铁的化学方程式为_____,使用的装置为_____。
【答案】2H2O2![]() 2H2O+O2↑ 2KMnO4
2H2O+O2↑ 2KMnO4![]() K2MnO4+MnO2+O2↑ G B或D CaCO3+2HCl=CaCl2+H2O+CO2↑ AB或EB 4CO+Fe3O4
K2MnO4+MnO2+O2↑ G B或D CaCO3+2HCl=CaCl2+H2O+CO2↑ AB或EB 4CO+Fe3O4![]() 3Fe+4CO2 F
3Fe+4CO2 F
【解析】
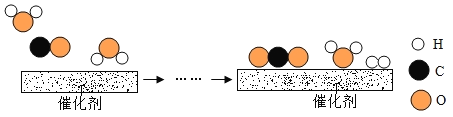
(1)过氧化氢以二氧化锰为催化剂生成水和氧气;高锰酸钾加热生成锰酸钾、二氧化锰和氧气;其反应物的状态是固态,反应条件是加热,应选固﹣固加热型的发生装置;氧气密度比空气大,不易溶于水,可用排水法或向上排空气法收集。故答案为:2H2O2![]() 2H2O+O2↑;2KMnO4
2H2O+O2↑;2KMnO4![]() K2MnO4+MnO2+O2↑;G;B或D
K2MnO4+MnO2+O2↑;G;B或D
(2)实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳,其反应物的状态是固态和液态,反应条件是常温,应选固﹣液不加热型的发生装置即装置A或E,二氧化碳的密度比空气大,能溶于水,只能用向上排空气法收集即装置B.大理石(或石灰石)的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳;故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;AB或EB;
(3)在高温的条件下,一氧化碳能将四氧化三铁还原为铁,同时生成二氧化碳;所用装置是F;故填:4CO+Fe3O4![]() 3Fe+4CO2;F。
3Fe+4CO2;F。

 备战中考寒假系列答案
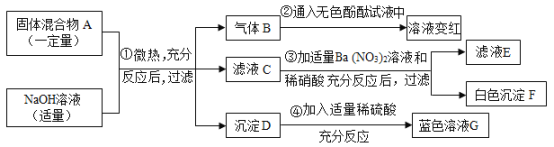
备战中考寒假系列答案【题目】2019年5月,187个国家签署了限制塑料废物交易协定,应对“白色污染”挑战。已知某种塑料的组成元素中有碳、氢两种元素,还可能有氧、氯元素中的一种或两种。为了测定其组成,某化学兴趣小组进行如下的探究。
(查阅资料)①无水氯化钙固体可做干燥剂;②有机物中的氯元素燃烧后通常转化为氯化氢。
(设计实验)兴趣小组设计并进行了如图所示的实验。(装置气密性良好)
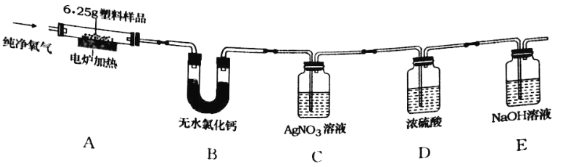
实验过程中,在装置C中观察到________现象,证明该塑料样品中含有氯元素,该反应的化学方程式是________。
(记录数据)6.25g样品在A装置中充分燃烧,反应产物被完全吸收后,测得相关实验数据如表。
装置 | B | C | D | E |
反应后装置增加的质量/g | 1.80 | 3.65 | 0.09 | 8.80 |
(分析与结论)根据以上数据分析与计算,6.25g样品中氢元素的质量为________g,该塑料样品的组成元素是________。
(反思评价)电炉加热前要先通一会儿氧气,目的是________。