题目内容
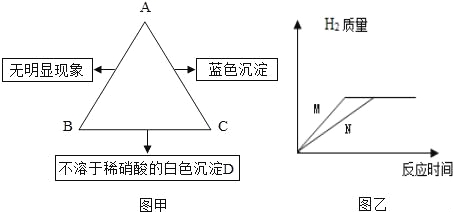
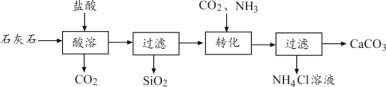
【题目】某化学兴趣小组学习酸、碱、盐性质后,通过实验对硫酸、氢氧化钙的化学性质进行了验证和总结,如图所示“——”表示物质两两之间能发生化学反应,请根据图,回答问题。
总结一:硫酸的化学性质
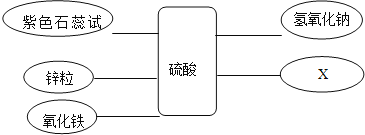
①写出氧化铁与硫酸的化学方程式______。
②补充一个实验,完善硫酸的化学性质,X可以是______(用化学式表示)。
③能发生中和反应的化学方程式______。
总结二:氢氧化钙的化学性质

(已知:CaCl2溶液呈中性,CaCl2+Na2CO3=CaCO3↓+2NaCl)
④乙同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈______(填“酸性”、“碱性”或“中性”)。
⑤丙同学将过量的稀盐酸加入到乙同学所得溶液中,观察到红色褪去,此时所得溶液中含有的溶质有______(酸碱指示剂除外),请设计实验证明盐酸过量:______。
⑥丁同学将碳酸钠溶液加入滴有酚酞的氢氧化钙溶液中,充分反应后,观察到的现象:______; 反应后溶液中的溶质一定有______。
【答案】Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O Na2CO3 2NaOH+H2SO4=Na2SO4+2H2O 碱性 HCl、CaCl2 向所得溶液中加入锌粒,若有气泡产生,则盐酸过量(合理即可) 有沉淀生成 NaOH
【解析】
①氧化铁与稀硫酸反应生成硫酸铁和水,反应的方程式为:Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
②酸可以与指示剂、金属、金属氧化物、碱、盐反应,故说明X属于盐,可以是碳酸钠,化学式为:Na2CO3。
③酸可以与碱发生中和反应,如氢氧化钠可以与稀硫酸反应生成硫酸钠和水,反应的方程式为:2NaOH+H2SO4=Na2SO4+2H2O。
④酚酞遇到碱性物质变红,故由现象可知氢氧化钙显碱性。
⑤过量的稀盐酸与氢氧化钙反应生成氯化钙和水,溶液显酸性,故红色消失,此时溶液中的溶质为盐酸和氯化钙,化学式分别为HCl、CaCl2。
⑥碳酸钠可以与氢氧化钙反应生成白色的碳酸钙沉淀,故现象为由白色沉淀生成。碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,故只要有反应进行,一定有氢氧化钠生成,碳酸钠和氢氧化钙可能有一种剩余,可能恰好完全反应,故反应后一定有的溶质是氢氧化钠。