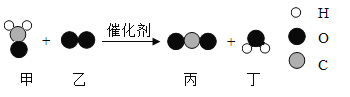
题目内容
【题目】轻质碳酸钙可用作牙膏摩擦剂。工业上常用石灰石(含有少量杂质)来制备比较纯净的轻质碳酸钙。
已知:①石灰石高温煅烧可以生成生石灰和二氧化碳,此外还有少量不反应的杂质剩余。②生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆。
某实验小组同学设计了2种转化流程,如下图所示。

请回答下列问题:
(1)石灰石高温煅烧反应的化学方程式是_____。
(2)物质C为_____,据你分析加水时沉淀池的温度会_____。(“升高”“降低”“不变”)
(3)反应④的化学方程式是_____。
(4)操作Ⅱ应采用的方法是_____。
(5)采用反应①②③制备轻质碳酸钙的方法优点有(写出一种即可)_____;采用反应①②④制备轻质碳酸钙的方法优点有(写出一种即可)_____。
【答案】CaCO3![]() CaO+CO2↑ CaO 升高 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 过滤 不需要额外增加反应物,节约成本;溶液之间的反应容易进行 可以同时生成重要的工业原料﹣﹣氢氧化钠等
CaO+CO2↑ CaO 升高 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 过滤 不需要额外增加反应物,节约成本;溶液之间的反应容易进行 可以同时生成重要的工业原料﹣﹣氢氧化钠等
【解析】
(1)石灰石煅烧会生成氧化钙与二氧化碳,反应的化学方程式是CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(2)C物质加水生成的氢氧化钙微溶于水出现沉淀,说明是氧化钙,氧化钙与水反应发出热量,温度会升高;
(3)④的反应是碳酸钠与氢氧化钙的反应,产物是碳酸钙与氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(4)该过程中是对碳酸钙沉淀于氢氧化钠溶液的分离,需要过滤操作完成;
(5)①②③使用的是制氧化钙生成的二氧化碳,既可以变废为宝,可以降低成本,也能减缓温室效应,①②④则是生成了氢氧化钠一种重要的化工原料。

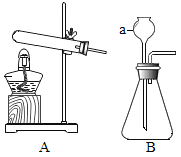
【题目】根据如图所示实验装置,回答问题.
发生装置 | 收集装置 | 洗气装置 |
|
|
|
(1)写出图中仪器a的名称:___.
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为___,可选择的收集装置为___(填字母).
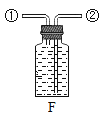
(3)实验室用石灰石和稀盐酸反应制取二氧化碳,可选择的发生装置是___,该反应生成的二氧化碳气体中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置除去氯化氢气体,则该混合气体应从F装置的___口(填“①”或“②”)通入.