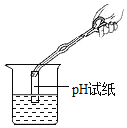
��Ŀ����
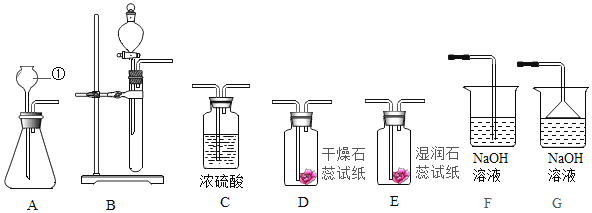
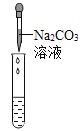
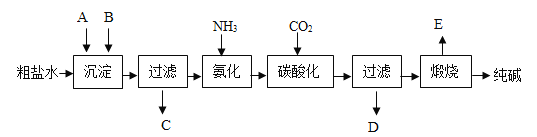
����Ŀ���ҹ�����ר�Һ�°������������Ƽ���������������з����ķ�Ӧ��Ҫ�ǣ��乤ҵ��������Ĺ�������ʾ��ͼ������ʾ�����������ˮ�м���ij�����A��B�ֱ�Ϊ�����ƺ�̼���ƣ�
�� NH3 + CO2 + H2O = NH4HCO3 �� NH4HCO3 + NaCl = NaHCO3�� + NH4Cl �� 2NaHCO3![]() Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
��ش��������⣺
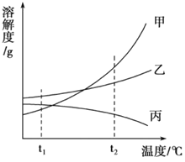
��1��ʵ�����ᴿ���ε�ʵ���������Ϊ��ȡ�����ܽ⡢���������ˡ������ᾧ��������ʱ������Һ�����������ǣ���ʵ������ĽǶȸ���һ�ֿ��ܵ�ԭ��______��
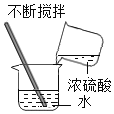
��2��ʵ�����У����ᴿ�õ����Ȼ�������100g 0.9%��������ˮ��ʹ�õ�������ҩ�ס���������������ƽ����ͷ�ιܡ��ձ��⣬����Ҫ�ʵ���������_________��
��3����������Ĺ��������У�̼�ữʱ����NaHCO3���壬û������Na2CO3�����ԭ����____��
��4�������������а�����������ѭ��ʹ�õģ�Ϊ�ˣ�����ҺD�м���ʯ��ˮ����������������д���÷�Ӧ�Ļ�ѧ����ʽ_________��
���𰸡���ֽ�����Һ��Һ�������ֽ��Ե 100mL����Ͳ NaHCO3���ܽ��С��Na2CO3������ܽ�� Ca��OH��2+2NH4Cl�TCaCl2 +2NH3��+2H2O
��������
��1�����˲����У�����ֽ���𡢻�©���ڵ�Һ�������ֽ�ı�Ե���������ɾ����ᵼ����Һ���ǣ������ֽ�����Һ��Һ�������ֽ��Ե��
��2������100g 0.9%��������ˮ��Ҫˮ������Ϊ��100g-100g��0.9%=99.1g�����Ϊ99.1mL������Ҫ100mL����Ͳ�����100mL����Ͳ��
��3������������̼�ữʱ���ῴ����Һ���������壬��������̼���Ƶ��ܽ�ȴ���̼�����ƣ����NaHCO3���ܽ��С��Na2CO3������ܽ�ȣ�
��4����ҺD����Ҫ�ɷ����Ȼ�泥��Ȼ�����������Ʒ�Ӧ�Ǻϳ��Ȼ��ơ�ˮ�Ͱ��������Ca��OH��2+2NH4Cl�TCaCl2 +2NH3��+2H2O��

 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д� ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д�����Ŀ����ѧ����Χ��������кͷ�Ӧ������ѧ���ֳ�����С��̽�������������һ���������ʵ��̽����
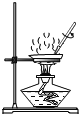
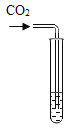
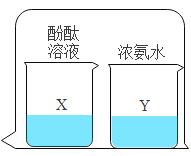
����ʾʵ�飩��һ����ϡ������뵽ʢ����������Һ��С�ձ��С��÷�Ӧ�Ļ�ѧ����ʽ�ǣ�_________���÷�Ӧ�Ļ�ѧ��Ӧ����������_____��
���������ϣ�CaCl2��Һ������
��������⣩ʵ����δ�۲쵽����������ͬѧ���������ʣ���Ӧ����Һ�����ʵijɷ���ʲô��
����������裩������ʣ�����ͬѧ�������£�
���� I��ֻ�� CaCl2 ���� II����_____
���� III���� CaCl2 �� Ca(OH)2 ���� IV���� CaCl2��HCl �� Ca(OH)2
����ͬѧ�����ϲ���������ɣ���Ϊ���� IV ����������������_____��
��ʵ��̽����Ϊ����֤������룬��С���������������������̽����
ʵ�鷽�� | �μ���ɫʯ����Һ | ͨ�� CO2 | �μ� Na2CO3 ��Һ |
ʵ����� |
|
|
|
ʵ������ | ______ | _____ | ������ɫ���� |
ʵ����� | ��Һ�к��У�Ca(OH)2 | ��Һ�к��У�Ca(OH)2 | ��Һ�к��У�Ca(OH)2 |
���ó����ۣ�ͨ��̽����ȫ��ͬѧһ��ȷ������ III ����ȷ�ġ�
�����۷�˼��
��1������ͬѧ��Ϊ�μ�Na2CO3��Һ������ɫ������������֤����Һ��һ������Ca(OH)2�������������˵��ԭ��_____��
��2���ڷ�����Ӧ��������Һ�����ʵijɷ�ʱ�����˿����������⣮����Ҫ����_____
����Ŀ����ѧ��һ����ʵ��Ϊ��������Ȼѧ�ơ�������ͼʾ��ʵ������У��ܴﵽʵ��Ŀ�ĵIJ�����
ʵ�����ͼʾ |
|
|
|
|
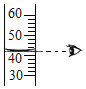
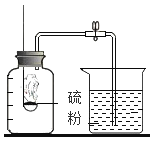
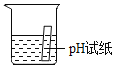
ѡ�� | A̽�������˶� | B��ȡ35mLҺ�� | C�ⶨ������O2���� | D�ⶨ��Һ��pH |
A.AB.BC.CD.D