题目内容
(1)用化学用语填写下列空格:
①2个氨气分子 ②相对分子质量最小的氧化物
③有毒的氧化物 ④能支持动物呼吸的一种单质 ;
(2)有A、B、C三种元素的粒子,其核电荷数之和是36,A粒子只有一个质子(无中子电子);B粒子原子核外有18个电子,显负电性,A与B能形成化合物AB;C粒子显电中性,根据上述事实写出三种粒子的化学符号:
A 、B 、C
(3)氮化硅陶瓷是一种新型陶瓷材料,能承受高温,可用于制造业、航天工业等领域.
①氮元素与硅元素最本质的区别是 ;
②由结构示意图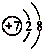 可知,氮原子最外层电子数目为 ;
可知,氮原子最外层电子数目为 ;
③工业上生产氮化硅陶瓷的方法之一是利用硅与氮气在一定条件下发生反应而制得,原料硅主要是由石英砂(主要成分是二氧化硅)与碳在一定条件下反应制得,生成物除硅外,还有一种有毒的氧化物.试写出该反应的化学方程式 .
④氮气在一般情况下不燃也不助燃,但研究发现镁在空气中燃烧产物中有少许微黄色的固体,经过研究人员测定这种微黄色的固体是镁和空气的氮气反应生成的氮化镁,现有72克的镁在氮气中充分燃烧会生成 克的氮化镁.
(4)二氧化碳若合理利用,是一种与水一样重要的原料.
Ⅰ、最近,美国研究人员利用镍和钯作催化剂,将二氧化碳转化为具有多种用途的一氧化碳或甲醇.
①该转化属于 (填“物理”或“化学”)变化;其催化剂是两种 (填“金属”或“非金属”).
②甲醇(CH3OH)可用作赛车燃料.若其燃烧产物与蜡烛燃烧产物相同,则其化学方程式为 .
Ⅱ、日本核灾难后,清洁煤电受到追捧.我国已成功运行燃煤电厂二氧化碳捕集技术,使液态二氧化碳成为最终产品.以二氧化碳为原料可生产更环保的碳基钾肥,如碳酸钾等.碳酸钾中的阴离子是 (用离子符号表示).
①2个氨气分子
③有毒的氧化物
(2)有A、B、C三种元素的粒子,其核电荷数之和是36,A粒子只有一个质子(无中子电子);B粒子原子核外有18个电子,显负电性,A与B能形成化合物AB;C粒子显电中性,根据上述事实写出三种粒子的化学符号:
A
(3)氮化硅陶瓷是一种新型陶瓷材料,能承受高温,可用于制造业、航天工业等领域.
①氮元素与硅元素最本质的区别是
②由结构示意图
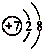 可知,氮原子最外层电子数目为
可知,氮原子最外层电子数目为③工业上生产氮化硅陶瓷的方法之一是利用硅与氮气在一定条件下发生反应而制得,原料硅主要是由石英砂(主要成分是二氧化硅)与碳在一定条件下反应制得,生成物除硅外,还有一种有毒的氧化物.试写出该反应的化学方程式
④氮气在一般情况下不燃也不助燃,但研究发现镁在空气中燃烧产物中有少许微黄色的固体,经过研究人员测定这种微黄色的固体是镁和空气的氮气反应生成的氮化镁,现有72克的镁在氮气中充分燃烧会生成
(4)二氧化碳若合理利用,是一种与水一样重要的原料.
Ⅰ、最近,美国研究人员利用镍和钯作催化剂,将二氧化碳转化为具有多种用途的一氧化碳或甲醇.
①该转化属于
②甲醇(CH3OH)可用作赛车燃料.若其燃烧产物与蜡烛燃烧产物相同,则其化学方程式为
Ⅱ、日本核灾难后,清洁煤电受到追捧.我国已成功运行燃煤电厂二氧化碳捕集技术,使液态二氧化碳成为最终产品.以二氧化碳为原料可生产更环保的碳基钾肥,如碳酸钾等.碳酸钾中的阴离子是
分析:(1)①分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字.
②相对分子质量最小的氧化物是水,写出其化学式即可.
③一氧化碳能与血液中的血红蛋白结合,是一种有毒的氧化物.
④氧气能供给呼吸,是能支持动物呼吸的一种单质.
(2)根据A粒子只有一个质子(无中子、电子),可知A粒子为氢离子H+;根据粒子原子核外有18个电子,显负电性,A与B能形成化合物AB,可知B粒子带一个单位的负电荷,故核内质子数为17,故B为氯离子Cl-;根据三种粒子的核电荷数之和是36可知,C粒子的核电荷数为:36-1-17=18,C粒子显电中性,故C为氩原子.(3)①根据元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),据此进行分析解答.
②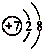 是氮原子得到3个电子得到的,据此进行分析解答.
是氮原子得到3个电子得到的,据此进行分析解答.
③石英砂(主要成分是二氧化硅)与碳在一定条件下反应制得,生成物除硅外,还有一种有毒的氧化物;由质量守恒定律,反应前后元素种类不变,可知有毒的物质是一氧化碳,即二氧化硅和碳在一定的条件下生成硅和一氧化碳.
④镁和空气的氮气反应生成的氮化镁,写出反应的化学方程式,由镁的质量计算出氮化镁的质量即可.
(4)Ⅰ、①根据题意,美国研究人员利用镍和钯作催化剂,将二氧化碳转化为具有多种用途的一氧化碳或甲醇,据此进行分析解答.
②蜡烛燃烧生成二氧化碳和水,则甲醇和氧气在点燃的条件下生成二氧化碳和水,写出反应的化学方程式即可.
Ⅱ、碳酸钾中的阴离子是碳酸根离子,写出其离子符号即可.
②相对分子质量最小的氧化物是水,写出其化学式即可.
③一氧化碳能与血液中的血红蛋白结合,是一种有毒的氧化物.
④氧气能供给呼吸,是能支持动物呼吸的一种单质.
(2)根据A粒子只有一个质子(无中子、电子),可知A粒子为氢离子H+;根据粒子原子核外有18个电子,显负电性,A与B能形成化合物AB,可知B粒子带一个单位的负电荷,故核内质子数为17,故B为氯离子Cl-;根据三种粒子的核电荷数之和是36可知,C粒子的核电荷数为:36-1-17=18,C粒子显电中性,故C为氩原子.(3)①根据元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),据此进行分析解答.
②
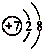 是氮原子得到3个电子得到的,据此进行分析解答.
是氮原子得到3个电子得到的,据此进行分析解答.③石英砂(主要成分是二氧化硅)与碳在一定条件下反应制得,生成物除硅外,还有一种有毒的氧化物;由质量守恒定律,反应前后元素种类不变,可知有毒的物质是一氧化碳,即二氧化硅和碳在一定的条件下生成硅和一氧化碳.
④镁和空气的氮气反应生成的氮化镁,写出反应的化学方程式,由镁的质量计算出氮化镁的质量即可.
(4)Ⅰ、①根据题意,美国研究人员利用镍和钯作催化剂,将二氧化碳转化为具有多种用途的一氧化碳或甲醇,据此进行分析解答.
②蜡烛燃烧生成二氧化碳和水,则甲醇和氧气在点燃的条件下生成二氧化碳和水,写出反应的化学方程式即可.
Ⅱ、碳酸钾中的阴离子是碳酸根离子,写出其离子符号即可.
解答:解:(1)①由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则2个氨气分子分别可表示为:2NH3.
②相对分子质量最小的氧化物是水,其化学式为:H2O.
③一氧化碳能与血液中的血红蛋白结合,是一种有毒的氧化物,其化学式为:CO.
④氧气能供给呼吸,是能支持动物呼吸的一种单质,其化学式为:O2.
(2)A粒子只有一个质子(无中子、电子),可知A粒子为氢离子H+;根据粒子原子核外有18个电子,显负电性,A与B能形成化合物AB,可知B粒子带一个单位的负电荷,故核内质子数为17,故B为氯离子Cl-;根据三种粒子的核电荷数之和是36可知,C粒子的核电荷数为:36-1-17=18,C粒子显电中性,故C为氩原子.
(3)①元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),不同种元素最本质的区别是质子数(即核电荷数)不同.
②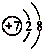 是氮原子得到3个电子得到的,氮原子最外层电子数目为10-2-3=5.
是氮原子得到3个电子得到的,氮原子最外层电子数目为10-2-3=5.
③石英砂(主要成分是二氧化硅)与碳在一定条件下反应制得,生成物除硅外,还有一种有毒的氧化物;由质量守恒定律,反应前后元素种类不变,可知有毒的物质是一氧化碳,二氧化硅和碳在一定的条件下生成硅和一氧化碳,反应的化学方程式为SiO2+2C
Si+2CO↑.
④镁和空气的氮气反应生成的氮化镁,反应的化学方程式为3Mg+N2
Mg3N2
72 100
72g x
设生成的氮化镁的质量为x,则
=
x=100g
(4)Ⅰ、①美国研究人员利用镍和钯作催化剂,将二氧化碳转化为具有多种用途的一氧化碳或甲醇,有新物质生成,属于化学变化.镍和钯作催化剂,是两种金属.
②蜡烛燃烧生成二氧化碳和水,则甲醇和氧气在点燃的条件下生成二氧化碳和水,反应的化学方程式为:2CH3OH+3O2
2CO2+4H2O.
Ⅱ、碳酸钾中的阴离子是碳酸根离子,其离子符号为:CO32-.
故答案为:(1)①2NH3;②H2O;③CO;④O2;(2)H+;Cl-;Ar;(3)①质子数(即核电荷数)不同;②5;③SiO2+2C
Si+2CO↑;④100;(4)Ⅰ、①化学;金属;②2CH3OH+3O2
2CO2+4H2O;Ⅱ、CO32-.
②相对分子质量最小的氧化物是水,其化学式为:H2O.
③一氧化碳能与血液中的血红蛋白结合,是一种有毒的氧化物,其化学式为:CO.
④氧气能供给呼吸,是能支持动物呼吸的一种单质,其化学式为:O2.
(2)A粒子只有一个质子(无中子、电子),可知A粒子为氢离子H+;根据粒子原子核外有18个电子,显负电性,A与B能形成化合物AB,可知B粒子带一个单位的负电荷,故核内质子数为17,故B为氯离子Cl-;根据三种粒子的核电荷数之和是36可知,C粒子的核电荷数为:36-1-17=18,C粒子显电中性,故C为氩原子.
(3)①元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),不同种元素最本质的区别是质子数(即核电荷数)不同.
②
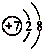 是氮原子得到3个电子得到的,氮原子最外层电子数目为10-2-3=5.
是氮原子得到3个电子得到的,氮原子最外层电子数目为10-2-3=5.③石英砂(主要成分是二氧化硅)与碳在一定条件下反应制得,生成物除硅外,还有一种有毒的氧化物;由质量守恒定律,反应前后元素种类不变,可知有毒的物质是一氧化碳,二氧化硅和碳在一定的条件下生成硅和一氧化碳,反应的化学方程式为SiO2+2C
| ||
④镁和空气的氮气反应生成的氮化镁,反应的化学方程式为3Mg+N2
| ||
72 100
72g x
设生成的氮化镁的质量为x,则
| 72 |
| 100 |
| 72g |
| x |
(4)Ⅰ、①美国研究人员利用镍和钯作催化剂,将二氧化碳转化为具有多种用途的一氧化碳或甲醇,有新物质生成,属于化学变化.镍和钯作催化剂,是两种金属.
②蜡烛燃烧生成二氧化碳和水,则甲醇和氧气在点燃的条件下生成二氧化碳和水,反应的化学方程式为:2CH3OH+3O2
| ||
Ⅱ、碳酸钾中的阴离子是碳酸根离子,其离子符号为:CO32-.
故答案为:(1)①2NH3;②H2O;③CO;④O2;(2)H+;Cl-;Ar;(3)①质子数(即核电荷数)不同;②5;③SiO2+2C
| ||
| ||
点评:本题难度不大,掌握常见化学用语的书写方法(分子符号、化学式、离子符号、化学方程式等)的书写方法、元素的特征、粒子结构示意图的含义等是正确解答本题的关键.

练习册系列答案
相关题目
 按要求填空.
按要求填空. 按要求填空.
按要求填空.