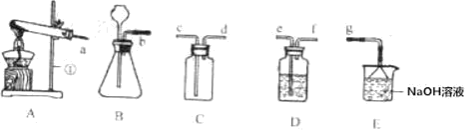题目内容
【题目】某校化学研究性学习小组探究气体制取的实验原理与方法。
(1)小明准备了如下药品“块状石灰石、二氧化锰、氯酸钾、稀硫酸”,请你帮助他完成相 关内容。
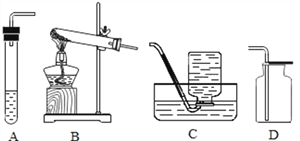
利用上述药品制取某种气体,发生反应的化学方程式为_____,请选择制取 该气体的发生装置_____。
(2)小明进行了“粗盐中难溶性杂质的去除”实验。进行该实验时,过滤、蒸发时都需用 到的仪器是_____(填序号)。
a.酒精灯 b.烧杯 c.玻璃棒 d.漏斗 e.量筒
(3)小明用 6.5g 可能含有铜、铝、铁、镁几种金属杂质的锌粉,跟足量的稀盐酸完全反应 时,生成 0.2g 氢气,则此锌粉中一定含有的金属杂质是_____。
【答案】 2KClO3![]() 2KCl+3O2↑ B C 铜(或Cu)
2KCl+3O2↑ B C 铜(或Cu)
【解析】本题考查了制取气体的反应原理,发生装置的选择,过滤、蒸发中仪器的使用,根据化学方程式的计算。
(1)上述药品中的二氧化锰和氯酸钾在加热时能制取氧气,发生反应的化学方程式为2KClO3![]() 2KCl+3O2↑;该是固体加热制取氧气,选择的发生装置是B;
2KCl+3O2↑;该是固体加热制取氧气,选择的发生装置是B;
(2)在过滤、蒸发操作中都要用到玻璃棒,过滤实验中要用玻璃棒引流;蒸发实验中要用玻璃棒搅拌,故选C;
(3)设:假设6.5g金属都是锌时,可生成氢气X
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5g X
![]() X=0.2g;可知6.5g都是锌可生成氢气0.2g,6.5g含杂质的锌也生成0.2gH2,说明杂质也有与酸反应金属存在,但考虑到铝、铁、镁的相对原子质量都比锌小,再由规律:相同价态、相同质量不同种金属与足量的酸反应相对原子质量越小,产生的氢气越多,由此推知,杂质至少由两种金属组成,且每种组成中都含有Cu。所以锌粉中一定含有的金属杂质是铜(或Cu)。
X=0.2g;可知6.5g都是锌可生成氢气0.2g,6.5g含杂质的锌也生成0.2gH2,说明杂质也有与酸反应金属存在,但考虑到铝、铁、镁的相对原子质量都比锌小,再由规律:相同价态、相同质量不同种金属与足量的酸反应相对原子质量越小,产生的氢气越多,由此推知,杂质至少由两种金属组成,且每种组成中都含有Cu。所以锌粉中一定含有的金属杂质是铜(或Cu)。

 名校课堂系列答案
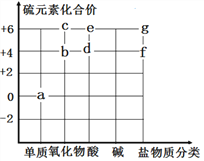
名校课堂系列答案【题目】请分析如图盐的化学性质知识网络,完成下列问题:
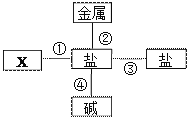
(1)图中的X填写___________(填物质的类别);
(2)若金属为铜,盐为硝酸银,请写出反应②的化学方程式_______________;
(3)请根据下表所提供的部分物质的溶解性表,写出符合反应④的化学方程式__________。
OH- | NO3- | SO42- | |
Na+ | 溶 | 溶 | 溶 |
Cu2+ | 不 | 溶 | 溶 |
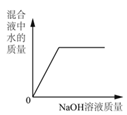
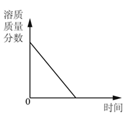
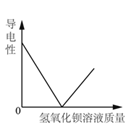
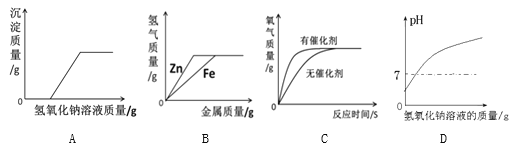
【题目】下列 4 个图像能正确反映对应变化关系是( )
A | B | C | D |
|
|
|
|
向一定量稀硫酸中加 入 NaOH 溶液 | 浓硫酸长期暴露在空 气中 | 向一定量的硫酸溶液 中逐滴滴入氢氧化钡 溶液至过量 | 相同条件下,加热质 量相等的两份固体,a 为氯酸钾和二氧化锰 的混合物,b 为氯酸 钾 |
A. A B. B C. C D. D