题目内容
工业上常用废铜屑跟热的稀硫酸和氧气反应制取硫酸铜:2Cu+O2+2H2SO4
2CuSO4+2H2O,现将25.6t废铜屑和368t热的稀硫酸混合,通入足量的氧气,恰好完全反应.试计算:
(1)参加反应的氧气有多少吨?
(2)可制得无水硫酸铜多少吨?
(3)反应后溶液中CuSO4的质量分数.
| ||
(1)参加反应的氧气有多少吨?
(2)可制得无水硫酸铜多少吨?
(3)反应后溶液中CuSO4的质量分数.
因通入足量的氧气,恰好完全反应,
则设参加反应的O2的质量为xt,生成的CuSO4质量为yt,则
2Cu+O2+2H2SO4
2CuSO4+2H2O
2×64 32 2×160
25.6t x y
=
=
解得x=6.4t,答:参加反应的氧气有6.4t;
解得y=64t,
答:可制得无水硫酸铜64t;
(3)反应后溶液的总质量为25.6t+368t+6.4t=400t,
则反应后溶液中CuSO4的质量分数为
×100%=16%,
答:反应后溶液中CuSO4的质量分数为16%.
则设参加反应的O2的质量为xt,生成的CuSO4质量为yt,则
2Cu+O2+2H2SO4
| ||
2×64 32 2×160
25.6t x y
| 2×64 |
| 25.6t |
| 32 |
| x |
| 2×?160 |
| y |
解得x=6.4t,答:参加反应的氧气有6.4t;
解得y=64t,
答:可制得无水硫酸铜64t;
(3)反应后溶液的总质量为25.6t+368t+6.4t=400t,
则反应后溶液中CuSO4的质量分数为
| 64t |
| 400t |
答:反应后溶液中CuSO4的质量分数为16%.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
 2CuSO4+2H2O,现将25.6t废铜屑和368t热的稀硫酸混合,通入足量的氧气,恰好完全反应.试计算:
2CuSO4+2H2O,现将25.6t废铜屑和368t热的稀硫酸混合,通入足量的氧气,恰好完全反应.试计算: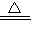 2CuSO4+2H2O,现将25.6t废铜屑和368t热的稀硫酸混合,通入足量的氧气,恰好完全反应.试计算:
2CuSO4+2H2O,现将25.6t废铜屑和368t热的稀硫酸混合,通入足量的氧气,恰好完全反应.试计算: