题目内容
工业上常用废铜屑跟热的稀硫酸和氧气反应制取硫酸铜:2Cu+O2+2H2SO4 2CuSO4+2H2O,现将25.6t废铜屑和368t热的稀硫酸混合,通入足量的氧气,恰好完全反应.试计算:
2CuSO4+2H2O,现将25.6t废铜屑和368t热的稀硫酸混合,通入足量的氧气,恰好完全反应.试计算:
(1)参加反应的氧气有多少吨?
(2)可制得无水硫酸铜多少吨?
(3)反应后溶液中CuSO4的质量分数.
解:因通入足量的氧气,恰好完全反应,
则设参加反应的O2的质量为xt,生成的CuSO4质量为yt,则
2Cu+O2+2H2SO4 2CuSO4+2H2O
2CuSO4+2H2O
2×64 32 2×160
25.6t x y
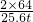 =
=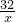 =
=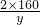
解得x=6.4t,答:参加反应的氧气有6.4t;
解得y=64t,
答:可制得无水硫酸铜64t;
(3)反应后溶液的总质量为25.6t+368t+6.4t=400t,
则反应后溶液中CuSO4的质量分数为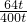 ×100%=16%,
×100%=16%,
答:反应后溶液中CuSO4的质量分数为16%.
分析:利用信息中的化学反应,将铜的质量代入化学反应方程式可计算氧气、无水硫酸铜的质量,再利用总质量守恒来计算溶液的质量,最后计算出反应后溶液中CuSO4的质量分数.
点评:本题考查学生利用化学反应方程式的计算,信息中的化学反应是计算的依据,然后将铜的质量代入计算是关键,能利用总质量守恒来计算反应后的溶液质量即可解答.
则设参加反应的O2的质量为xt,生成的CuSO4质量为yt,则
2Cu+O2+2H2SO4
 2CuSO4+2H2O
2CuSO4+2H2O2×64 32 2×160
25.6t x y
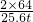 =
=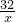 =
=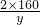
解得x=6.4t,答:参加反应的氧气有6.4t;
解得y=64t,
答:可制得无水硫酸铜64t;
(3)反应后溶液的总质量为25.6t+368t+6.4t=400t,
则反应后溶液中CuSO4的质量分数为
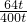 ×100%=16%,
×100%=16%,答:反应后溶液中CuSO4的质量分数为16%.
分析:利用信息中的化学反应,将铜的质量代入化学反应方程式可计算氧气、无水硫酸铜的质量,再利用总质量守恒来计算溶液的质量,最后计算出反应后溶液中CuSO4的质量分数.
点评:本题考查学生利用化学反应方程式的计算,信息中的化学反应是计算的依据,然后将铜的质量代入计算是关键,能利用总质量守恒来计算反应后的溶液质量即可解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2CuSO4+2H2O,现将25.6t废铜屑和368t热的稀硫酸混合,通入足量的氧气,恰好完全反应.试计算:
2CuSO4+2H2O,现将25.6t废铜屑和368t热的稀硫酸混合,通入足量的氧气,恰好完全反应.试计算: