题目内容
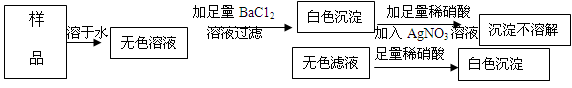
有一包粉末,可能由NaCl、MgCl2、FeCl3、Na2CO3、Na2SO4中的一种或几种组成.为了探究该粉末的组成,进行了如下实验:
(1)取样加水溶解,得到无色透明溶液.
(2)取(1)所得溶液少许,加入NaOH溶液,观察,没有明显现象.
(3)另取少量粉末,滴加稀盐酸,观察,也没有明显现象.
根据上述实验可得到的结论是:原粉末一定不含 MgCl2、FeCl3、Na2CO3,可能含有的物质是 NaCl、Na2SO4.
MgCl2、FeCl3、Na2CO3/NaCl、Na2SO4
解析试题分析:加水溶解,得到无色透明溶液,由于FeCl3溶液呈黄色,说明不含FeCl3;加入NaOH溶液,若有MgCl2那么会生成白色沉淀,现没有明显现象,说明不含MgCl2;滴加稀盐酸,观察,也没有明显现象,说明不含Na2CO3,若有,会有气泡产生。
考点:物质的推断

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
结合下图含钙元素物质间可以发生的转化关系。下列说法中,正确的是
| A.图中的五种物质,有三种属于氧化物 |
| B.转化①属于化合反应 |
| C.转化④⑥一定有水生成 |
| D.Ca在Cl2中燃烧可实现转化⑤,该反应说明燃烧 |