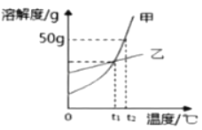
题目内容
【题目】有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加盐酸,现象如图所示(ABC表示沉淀变化,OBC表示气体变化)
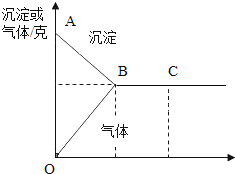
(1)由此推断原白色固体中一定含有的是______。
(2)在C点时,所得溶液中的溶质一定有______。
【答案】碳酸钠、硫酸钠和氯化钡 氯化钡、氯化氢、氯化钠
【解析】
(1)硫酸钠会与氯化钡反应生成硫酸钡沉淀,硫酸钡不溶于盐酸;碳酸钠会与氯化钡反应生成碳酸钡沉淀,碳酸钡沉淀会溶于盐酸;据图可以看出,将固体溶解于水,加入盐酸,沉淀减少,同时有气体生成,一段时间后,沉淀不再消失,气体也不再生成,故混合物中一定含有碳酸钡沉淀和硫酸钡沉淀,所以混合物中一定含有碳酸钠、硫酸钠和氯化钡;
(2)因为硫酸钠会与氯化钡反应生成硫酸钡沉淀和氯化钠;碳酸钠会与氯化钡反应生成碳酸钡沉淀和氯化钠;碳酸钡沉淀会溶于盐酸生成二氧化碳和氯化钡、水,在C点时,盐酸是过量的,故所得溶液中的溶质一定有氯化钡、氯化氢、氯化钠。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目