题目内容
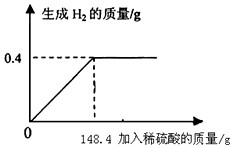
 向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:
向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:(1)样品中锌的质量分数.(保留一位小数)
(2)所用的稀硫酸中溶质的质量.
(3)恰好完全反应时,所得反应后溶液中溶质的质量分数.
分析:本题涉及的反应Zn+H2SO4═ZnSO4+H2↑,图象为充分反应所生成氢气的质量随加入稀硫酸质量的变化情况.根据曲线可确定加入148.4g稀硫酸时与锌恰好完全反应放出0.4g氢气,运用化学方程式可求反应的硫酸的质量,由氢气质量计算参加反应锌的质量及生成硫酸锌的质量,最后由质量守恒定律计算反应后所得溶液质量,完成所得溶液中溶质的质量分数的计算.
解答:解:设样品中锌的质量为x,生成硫酸锌的质量为y.反应的硫酸的质量是z,由图分析可知产生氢气0.4g.
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x z y 0.4g
=
=
=
x=13g y=32.2g z=19.6g
(1)样品中锌的质量分数为
×100%=81.25%
(2)所用的稀硫酸中溶质的质量为19.6g;
(3)恰好完全反应时,所得溶液中溶质的质量分数=
×100%=20%
答:(1)样品中锌的质量分数为81.25%;(2)所用的稀硫酸中溶质的质量为19.6g;(3)所得硫酸锌溶液中溶质的质量分数为20%.
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x z y 0.4g
| 65 |
| x |
| 98 |
| z |
| 161 |
| y |
| 2 |
| 0.4g |
x=13g y=32.2g z=19.6g
(1)样品中锌的质量分数为
| 13g |
| 16g |
(2)所用的稀硫酸中溶质的质量为19.6g;
(3)恰好完全反应时,所得溶液中溶质的质量分数=
| 32.2g |
| 13g+148.4g-0.4g |
答:(1)样品中锌的质量分数为81.25%;(2)所用的稀硫酸中溶质的质量为19.6g;(3)所得硫酸锌溶液中溶质的质量分数为20%.
点评:解答此类问题的根本点在于对反应图象的曲线进行分析,曲线的折点表示此时恰好完全反应.

练习册系列答案
相关题目
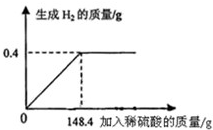
 向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示.
向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示.