题目内容
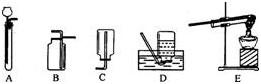
下列仪器能加热,但加热时需要垫上石棉网的是
- A.烧杯
- B.量筒
- C.试管
- D.蒸发皿
A
分析:A、根据烧杯使用的注意事项判断.
B、根据量筒的用途和使用的注意事项判断.
C、根据给试管加热的注意事项判断.
D、根据蒸发皿的使用方法判断.
解答:
A、烧杯底面积较大,加热时易受热不均而炸裂,故加热时需要垫上石棉网,所以正确.
B、量筒是量度液体体积的仪器,不能加热,所以错误.
C、试管底面积较小,只要加热前充分预热,就不会因受热不均而炸裂,故可直接加热,所以错误.
D、蒸发皿是瓷制的,导热性好,受热均匀,加热时不需要垫上石棉网,所以错误.
故选A.
点评:化学是一门以实验为基础的学科,化学实验是考查的重点、难点和热点,特别是基本操作,了解仪器的名称、用途、使用方法和注意事项,是解题的前提.
分析:A、根据烧杯使用的注意事项判断.
B、根据量筒的用途和使用的注意事项判断.
C、根据给试管加热的注意事项判断.
D、根据蒸发皿的使用方法判断.
解答:
A、烧杯底面积较大,加热时易受热不均而炸裂,故加热时需要垫上石棉网,所以正确.
B、量筒是量度液体体积的仪器,不能加热,所以错误.
C、试管底面积较小,只要加热前充分预热,就不会因受热不均而炸裂,故可直接加热,所以错误.
D、蒸发皿是瓷制的,导热性好,受热均匀,加热时不需要垫上石棉网,所以错误.
故选A.
点评:化学是一门以实验为基础的学科,化学实验是考查的重点、难点和热点,特别是基本操作,了解仪器的名称、用途、使用方法和注意事项,是解题的前提.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 22、气体的制备是化学实验基本技能之一.现利用下列仪器进行实验,请回答下列问题.
22、气体的制备是化学实验基本技能之一.现利用下列仪器进行实验,请回答下列问题.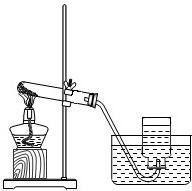 探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力.
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力.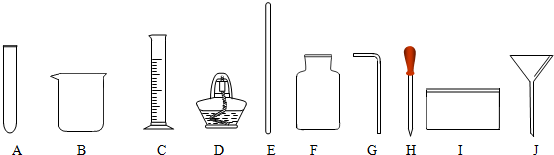

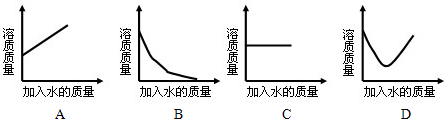
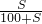 ×100%;
×100%;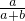 ×100%,若要使其溶质质量分数变为原来的
×100%,若要使其溶质质量分数变为原来的 倍,需加水________克.
倍,需加水________克.