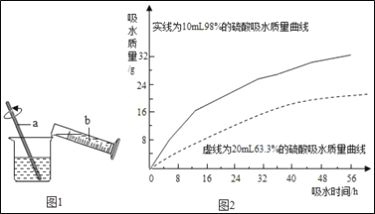
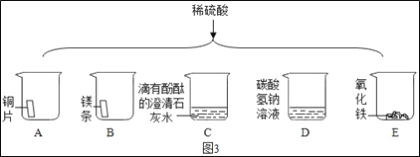
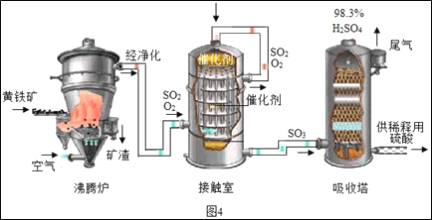
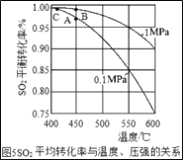
题目内容
【题目】现有指定化合价的几种元素:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,请选择元素,写出符合要求的化合物的化学式:
,请选择元素,写出符合要求的化合物的化学式:
(1)一种难溶于水的碱_____;
(2)一种酸_____;
(3)一种复合肥料_____;
(4)原子个数比为1:1的氧化物_____;
(5)一种水溶液为蓝色的盐_____。
【答案】Cu(OH)2 HNO3 KNO3 CuO Cu(NO3)2
【解析】
(1)碱是指在电离时产生的阴离子全部是氢氧根离子的化合物,根据提供的元素,氢氧化铜属于碱,难溶于水,铜元素显+2价,氢氧根显﹣1价,其化学式为:Cu(OH)2。故填:Cu(OH)2
(2)酸是指在电离时产生的阳离子全部是氢离子的化合物,根据提供的元素,硝酸符合要求,其化学式为:HNO3。故填:HNO3
(3)提供的元素,硝酸钾中含有氮元素和钾元素,属于复合肥,其化学式为:KNO3。故填:KNO3
(4)根据提供元素的化合价可知,氧元素显﹣2价,铜元素显+2价,可以组成氧化物﹣﹣氧化铜;故填:CuO
(5)由提供的元素组成的硝酸铜是一种盐,水溶液显蓝色;故填:Cu(NO3)2

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目