题目内容
将一定量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 0.25g,原混合物的质量可能是
- A.2g
- B.6g
- C.10g
- D.14g
B
分析:用极值法进行分析:假设混合物全部是镁或全部是锌或全部是铝,根据生成氢气0.25g,分别计算出它们的质量,应该选择介于最大值和最小值之间的值.
解答:设要生成H2 0.25g需要镁的质量为x则:
Mg+H2SO4═MgSO4+H2↑
24 2
x 0.25g
根据: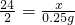 解得x=3g
解得x=3g
设要生成H2 0.25g需要锌的质量为y则:
Zn+H2SO4═ZnSO4+H2↑
65 2
y 0.25g
根据: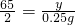 解得y=8.125g
解得y=8.125g
设要生成H2 0.25g需要铝的质量为z则:
2Al+3H2SO4═Al2(SO4)3+3H2↑
54 6
z 0.25g
根据: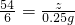 解得z=2.25g
解得z=2.25g
所以混合物的质量是大于2.25g,小于8.125g
故选B.
点评:解答本题关键是要知道使用极值法考虑问题的思路,设出金属属于纯净物,计算出各自的质量,混合后就是介于最大值和最小值之间的数值.
分析:用极值法进行分析:假设混合物全部是镁或全部是锌或全部是铝,根据生成氢气0.25g,分别计算出它们的质量,应该选择介于最大值和最小值之间的值.
解答:设要生成H2 0.25g需要镁的质量为x则:
Mg+H2SO4═MgSO4+H2↑
24 2
x 0.25g
根据:
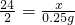 解得x=3g
解得x=3g设要生成H2 0.25g需要锌的质量为y则:
Zn+H2SO4═ZnSO4+H2↑
65 2
y 0.25g
根据:
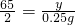 解得y=8.125g
解得y=8.125g设要生成H2 0.25g需要铝的质量为z则:
2Al+3H2SO4═Al2(SO4)3+3H2↑
54 6
z 0.25g
根据:
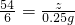 解得z=2.25g
解得z=2.25g所以混合物的质量是大于2.25g,小于8.125g
故选B.
点评:解答本题关键是要知道使用极值法考虑问题的思路,设出金属属于纯净物,计算出各自的质量,混合后就是介于最大值和最小值之间的数值.

练习册系列答案
相关题目
 ①曲线A表示的是
①曲线A表示的是