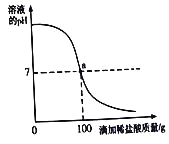
题目内容
【题目】早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,成为现代湿法冶金的先驱。现将2.8g 铁粉投入40g硫酸铜溶液中,充分搅拌后,两者恰好完全反应。请计算:
(1)反应后生成铜的质量是多少?
(2)反应前硫酸铜溶液中溶质的质量分数是多少?
(3)反应后溶液中溶质的质量分数是多少?(结果精确至0.1%)
【答案】(1)3.2g (2)20% (3)19.2%
【解析】(1)设生成铜的质量为x,生成硫酸亚铁的质量为A,消耗硫酸铜的质量为y
Fe + CuSO4 == Cu + FeSO4
56 160 64 152
2.8g y x A
![]()
x=3.2g
y=8g
A=7.6g
(2)反应前硫酸铜溶液中溶质的质量分数是![]() ×100%=20%
×100%=20%
(3)反应后溶液中溶质的质量分数是![]() ×100%=19.2%
×100%=19.2%
答:(1)反应后生成铜的质量是3.2g;
(2)反应前硫酸铜溶液中溶质的质量分数是20%;
(3)反应后溶液中溶质的质量分数是19.2%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(l)以下是有关CO2气体溶解度的几组数据:
CO2在水中的溶解度(单位:ml)
压强/大气压 | 温度/℃ | ||||
0 | 25 | 50 | 75 | 100 | |
1 | 1.79 | 0.752 | 0.423 | 0.307 | 0.231 |
10 | 15.92 | 7.14 | 4.095 | 2.99 | 2.28 |
25 | 29.30 | 16.20 | 9.71 | 6.82 | 5.73 |
请根据数据分析:
① 根据CO2在水中的溶解度表,叙述外界条件是如何影响气体溶解度的?_____、______;
② 打开可乐瓶有气体溢出,说明原瓶中的压强_____(填:小于、等于或大于)瓶外大气压强。
(2)右下图是无结晶水合物的固体甲和乙在水中的溶解度曲线,请根据该曲线图回答下列问题:
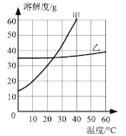
① 20℃时,150g水中溶解______g甲物质恰好形成饱和溶液。
② 现有60℃的乙的饱和溶液,与该溶液有关的量有:
A.水的质量 B.溶液中溶质的质量 C.溶液的质量
D.乙的质量分数 E.60℃时乙的溶解度
保持温度不变,将该饱和溶液稀释,不变的量是_(填序号,下同);如果将该饱和溶液降温至20℃,不变的量是_________。