题目内容
【题目】工业上用菱锰矿[主要成分为MnCO3,含FeCO3、Cu2(OH)2CO3、SiO2等杂质]为原料来制取二氧化锰,其生产流程示意图如下:
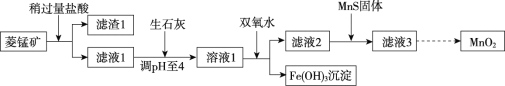
回答下列问题:
(1)将滤液与滤渣分离的操作是______。
(2)向菱锰矿中加入盐酸,MnCO3、FeCO3、Cu2(OH)2CO3都溶解并转化为MnCl2、FeCl2、CuCl2。盐酸与MnCO3反应的化学方程式为________。
(3)加入生石灰将溶液pH调至4,此时溶液呈________(填“酸性”或“碱性”)。
(4)加入双氧水将铁元素转化为Fe(OH)3沉淀,其反应为: 2FeCl2 + H2O2 + 4H2O = 2Fe(OH)3↓ + 4HCl,该反应化合价发生变化的元素是氧和_______。
(5)加入Na2S、MnS等硫化物,均可将MnCl2中混有的CuCl2转化为CuS沉淀除去,但实际生产中选用MnS,其原因是________。
【答案】过滤 MnCO3 + 2HCl = MnCl2 + CO2↑+ H2O 酸性 铁(或Fe) 除杂不引入新的杂质
【解析】
流程图菱锰矿中MnCO3,含FeCO3、Cu2(OH)2CO3、SiO2等杂质,加入过量稀盐酸后MnCO3,含FeCO3、Cu2(OH)2CO3,均反应生成其相应的氯化物,MnCl2、FeCl2、CuCl2;SiO2等杂质不与稀盐酸反应,故成为滤渣1,向滤液中加入生石灰,调节pH至4,得到溶液1,往溶液1中加入双氧水把FeCl2氧化成FeCl3,使氯化铁转化为氢氧化铁沉淀,过滤后得到滤液2,加入MnS固体把CuCl2转化为CuS沉淀除去CuCl2,过滤后得到滤液3,再经过后面的一系列步骤得到二氧化锰。
(1)用过滤的操作能将滤液与滤渣。故填:过滤
(2)向菱锰矿中加入盐酸,MnCO3、FeCO3、Cu2(OH)2CO3都溶解并转化为MnCl2、FeCl2、CuCl2。盐酸与MnCO3反应生成氯化锰、水和二氧化碳,其化学方程式为:MnCO3 + 2HCl = MnCl2 + CO2↑+ H2O;故填:MnCO3 + 2HCl = MnCl2 + CO2↑+ H2O
(3)加入生石灰将溶液pH调至4,此时pH仍小于7,故此时溶液呈酸性;故填:酸性
(4)加入双氧水将铁元素转化为Fe(OH)3沉淀,其反应方程式为:2FeCl2 + H2O2 + 4H2O = 2Fe(OH)3↓ + 4HCl,该反应中铁元素由+2价升到了+3价,氧元素由-1价降到了-2价;故化合价发生变化的元素是氧和铁;故填:铁(或Fe)
(5)加入Na2S、MnS等硫化物,均可将MnCl2中混有的CuCl2转化为CuS沉淀除去,但实际生产中选用MnS,因为加入MnS不引入杂质,而Na2S会引入新的杂质,导致后面较难提纯;故填:除杂不引入新的杂质

 阅读快车系列答案
阅读快车系列答案【题目】向饱和碳酸钠溶液中通入CO2会析出碳酸氢钠晶体而是溶液变浑浊,发生反应的化学方程式为Na2CO3 + CO2 + H2O = 2NaHCO3。某化学小组同学用下图装置探究影响碳酸氢钠晶体产生快慢的因素,结果如下表。下列判断不正确的是
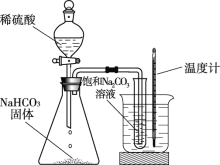
序号 | 温度/℃ | CO流速 (个气泡/秒) | 出现浑浊 的时间 |
① | 25 | 5~8 | 5′17″ |
② | 40 | 5~8 | 3′48″ |
③ | 25 | 10~13 | 5′02″ |
④ | 25 | 2~5 | 5′40″ |
A. 锥形瓶中反应的化学方程式为2NaHCO3 + H2SO4 = Na2SO4 + H2O + CO2↑
B. ①②对比可知,其他条件相同时,温度越高,析出晶体越快
C. ③④对比可知,其他条件相同时,CO2流速越大,析出晶体越快
D. ①③对比可知,二氧化碳的流速是影响析出晶体快慢的主要因素