题目内容
【题目】下列图示装置常用于实验室制取气体。请根据下图回答有关问题。
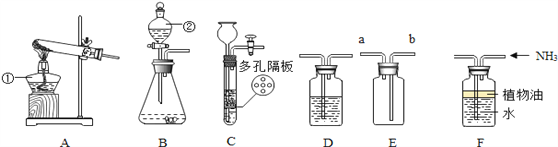
请结合图示实验装置,回答下列问题.
(1)写出①、②号仪器的名称:①____________________;②________________ ;
(2)用高锰酸钾制取氧气选用的发生装置是______(选填序号),反应的化学方程式为________;
(3)要获得干燥的O2,应先将气体通过盛有______(填名称)的D装置,气体应从_______端(填“左、右”)通入,再用E装置收集,气体应从______端通入(选填“a”或“b”),
(4)实验室可用B或C装置制CO2,反应的化学方程式为________,相对于B装置,C装置的优点有________。若制得的CO2气体不纯,可能的原因是________。
(5)已知NH3是一种无色有刺激性气味的气体,密度比空气的小,极易溶于水,实验室若用F装置收集NH3,油层的作用是______.
【答案】 酒精灯 分液漏斗 A 2KMnO4![]() K2MnO4+MnO2+O2↑ 浓硫酸 左 b CaCO3 + 2HCl = CaCl2 + CO2 + H2O, 随时对地控制反应速度、节约药品 盐酸浓度过大 防止氨气溶于水
K2MnO4+MnO2+O2↑ 浓硫酸 左 b CaCO3 + 2HCl = CaCl2 + CO2 + H2O, 随时对地控制反应速度、节约药品 盐酸浓度过大 防止氨气溶于水
【解析】(1)据图可知①号仪器的名称是酒精灯;②号仪器的名称是分液漏斗;(2)高锰酸钾在加热的条件下可以分解产生二氧化锰、锰酸钾和氧气;化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑,实验室用高锰酸钾制取氧气时,反应物的状态是固体,反应条件是加热,可选用的气体发生装置是A;(3)浓硫酸具有吸水性,而氢氧化钠溶液没有吸水性,所以应该用浓硫酸来进行干燥,并从长管进入;氧气的密度比空气大,所以用E装置来收集氧气时,氧气从长管进入;(4)实验室可用B或C装置制CO2,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;C相对于B装置的优点是能使反应随时进行或停止;盐酸浓度过大会挥发出氯化氢气体;(5)若用F装置收集NH3,油层的作用是防止氨气溶于水。
K2MnO4+MnO2+O2↑,实验室用高锰酸钾制取氧气时,反应物的状态是固体,反应条件是加热,可选用的气体发生装置是A;(3)浓硫酸具有吸水性,而氢氧化钠溶液没有吸水性,所以应该用浓硫酸来进行干燥,并从长管进入;氧气的密度比空气大,所以用E装置来收集氧气时,氧气从长管进入;(4)实验室可用B或C装置制CO2,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;C相对于B装置的优点是能使反应随时进行或停止;盐酸浓度过大会挥发出氯化氢气体;(5)若用F装置收集NH3,油层的作用是防止氨气溶于水。

【题目】自动充气气球因使用方便,无需其它充气器材而逐渐得以推广。某化学兴趣小组对自动充气气球进行了如下探究。

(查阅资料)①自动充气气球的结构如图所示,气球的充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
②氯化银是一种白色沉淀且不溶于稀硝酸。
(1)探究液体包的成分:
取液体包中的少量溶液分别放于两只于试管中,在其中一只试管中加入锌粒产生气泡,另一只试管中滴加硝酸银溶液,产生白色沉淀,继续滴加稀硝酸沉淀不溶,则小组同学证明液体包中装的是________,写出该液体与锌粒反应的化学方程式____________。
(2)探究白色粉末成分:
(猜想与假设)甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠。
(设计并进行实验)实验一:完成下表
操作步骤 | 现象 | 结论 |
甲同学的猜想不正确 |
实验二:按下图的实验装置,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的烧瓶中注入等体积、足量的稀盐酸,并测量生成二氧化碳的体积,记录如下表:

实验编号 | 锥形瓶内物质 | 最终得到CO2 体积/mL | |
名称 | 质量/g | ||
① | 碳酸氢钠 | 0.8 | V1 |
② | 碳酸钠 | 0.8 | V2 |
③ | 白色粉末 | a | V1 |
(3)实验装置中植物油的作用是___;表中a= ___;V1____V2(填“>”、“<”或“=”)。
(分析并得出结论)(4)分析上表中数据得出结论:白色粉末的成分是__________,依据是______。