题目内容
【题目】在盐酸和氢氧化钠反应的过程中,如图是利用数字化传感器得到的溶液pH变化图象。
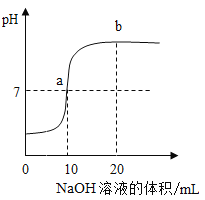
(1)反应的化学方程式为_____________________。
(2)当溶液呈中性时,所消耗氢氧化钠溶液的体积是______mL;
(3)图中b点所示溶液中,含有的溶质是 ____________ ;
(4)把两者液体混合时出现了气泡,用化学方程式表示为 ____________________________。
【答案】NaOH+HCl=NaCl+H2O 10 NaOH和NaCl Na2CO3+2HCl=2NaCl+H2O+CO2↑
【解析】
(1)氢氧化钠和盐酸反应生成氯化钠和水,反应的化学方程式为![]() 。
。
(2)当溶液呈中性时,即溶液的pH=7,由图像知,此时消耗氢氧化钠溶液的体积是10mL。
(3)b点时, 溶液的pH>7,溶液显碱性,说明氢氧化钠过量故溶液中含有的溶质是NaOH和NaCl。
(4)把两者液体混合时出现了气泡,可能是氢氧化钠变质生成了碳酸钠,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,化学方程式为![]() 。
。

练习册系列答案
相关题目
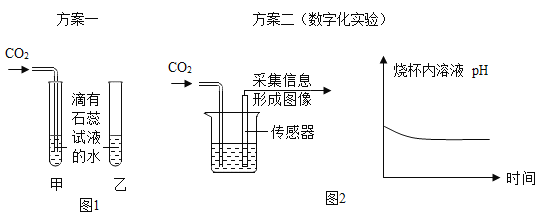
【题目】为了验证二氧化碳能和水反应,取四朵用石蕊溶液染成紫色的干燥纸花完成如下实验。
实验1 |
实验2 |
实验3 |
实验4 |
(1)纸花变为红色的实验有________(填实验序号)。
(2)实验1的作用是________。
(3)能证明水和二氧化碳发生了化学反应的现象是________。