题目内容
【题目】某校化学研究小组同学利用数字化实验室对初中化学常见的实验进行了探究活动。
(1)探究二氧化碳与水的反应
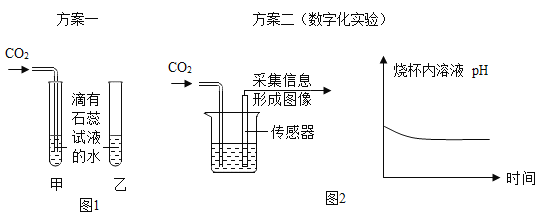
Ⅰ.图1中可观察到甲试管中的紫色液体变为红色,乙试管的作用是______;
Ⅱ.由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变____(填“强”或“弱”).
(2)探究蜡烛燃烧的产物二氧化碳和水。 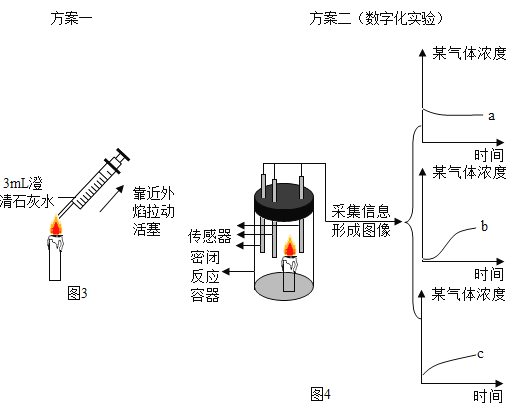
Ⅰ.如图3所示,用注射器在蜡烛外焰部位抽气并振荡,可观察到________,证明反应生成了二氧化碳.
Ⅱ.如图4所示,蜡烛在密闭容器内燃烧,同时监测容器内氧气、二氧化碳和水蒸气含量的变化,形成三条曲线如坐标图所示。曲线____(填“a”“b”或“c”)能够说明蜡烛燃烧生成了__________ 。
(3)比较块状碳酸钙、碳酸钙粉末与稀盐酸反应的速度:
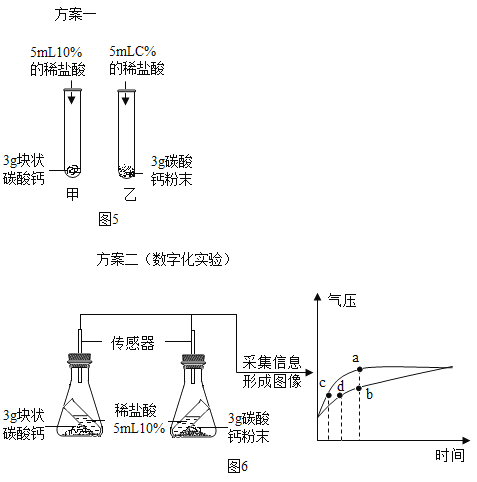
Ⅰ.图5中,乙试管中稀盐酸的浓度C%应为______。
Ⅱ.按图6所示进行实验,倾斜锥形瓶使小试管内的稀盐酸流入瓶中与固体接触发生反应,瓶内气压的变化如坐标图所示.对比分析坐标图中的点____(填ad)可知:两个锥形瓶内达到相同的压强时,碳酸钙粉末与稀盐酸反应所需时间更短。
【答案】对照 强 石灰水变浑浊 b、c 二氧化碳和水 10% cd
【解析】
(1)Ⅰ.由于二氧化碳与水化合生成了碳酸,所以图1中可观察到甲试管中的紫色液体变为红色,乙试管的作用是与甲试管起对照作用。
Ⅱ.由图2坐标图中的曲线可知,溶液的pH逐渐变小,说明了烧杯内溶液的酸性逐渐变强。
(2)Ⅰ.由于二氧化碳能与氢氧化钙反应生成碳酸钙和水,如图3所示,用注射器在蜡烛外焰部位抽气并振荡,可观察到石灰水变浑浊,证明反应生成了二氧化碳。
Ⅱ.蜡烛燃烧消耗了氧气,生成了二氧化碳和水,由图4知,曲线b、c气体的浓度不断增大,能够说明蜡烛燃烧生成了二氧化碳和水。
(3)Ⅰ.要比较块状碳酸钙、碳酸钙粉末与稀盐酸反应的速度,稀盐酸的浓度应相同,故乙试管中稀盐酸的浓度C%应为10%。
Ⅱ.对比分析坐标图中的点c、d可知:两个锥形瓶内达到相同的压强时,碳酸钙粉末与稀盐酸反应所需时间更短。

 字词句篇与同步作文达标系列答案
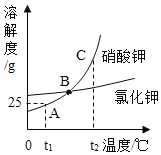
字词句篇与同步作文达标系列答案【题目】NaCl和KNO3在不同温度时的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
下列说法正确的是
A.10℃时,将40g NaCl固体加入l00g水中,可得到l40gNaCl溶液
B.KNO3和NaCl的溶解度受温度的影响都很大
C.将30℃的KNO3饱和溶液升温至60℃,会变成不饱和溶液
D.20℃时,NaCl饱和溶液的溶质质量分数为36%